
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大李丹课题组揭示PMEL组装聚集形成黑色素体的全新机制
黑色素体(melanosome)是决定皮肤、毛发和眼睛颜色的关键细胞器。其生物发生和功能失衡导致多种遗传性低色素综合征、黑色素瘤及相关系统性疾病。研究人员早期就注意到其内部存在规则的片层状结构,但这些片层如何由黑色素体结构蛋白 PMEL 组装而成、在原位呈现何种三维构型,一直缺乏原子分辨率的直接证据。

2025年11月21日,上海交通大学Bio-X研究院李丹,中国科学院生物与化学交叉研究中心刘聪,及复旦大学附属肿瘤医院陈勇团队合作在Nature Communications发表题为“Atomic structure and in situ visualization of native PMEL lamellae in melanosomes”的研究论文。团队首次解析人源PMEL在黑色素体中组装形成的“片层”结构,并结合冷冻电镜单颗粒与冷冻电镜断层成像(cryo-EM / cryo-ET)技术,实现了从细胞器尺度到原子分子尺度的一体化结构描绘。该工作为PMEL的组装机制、黑色素体的生物发生,以及相关色素疾病与黑色素瘤发生机制提供了重要结构基础。
已有研究表明,PMEL 是黑色素体早期阶段特异表达的跨膜糖蛋白,其胞内片段可聚集形成功能性淀粉样纤维,为黑色素聚合与沉积提供支架。经典超薄切片电镜中可见黑色素体内部呈现规则的条纹或片层,但这些密度究竟对应单根纤维的随机堆积,还是高度有序的片层排列,一直存在争议。
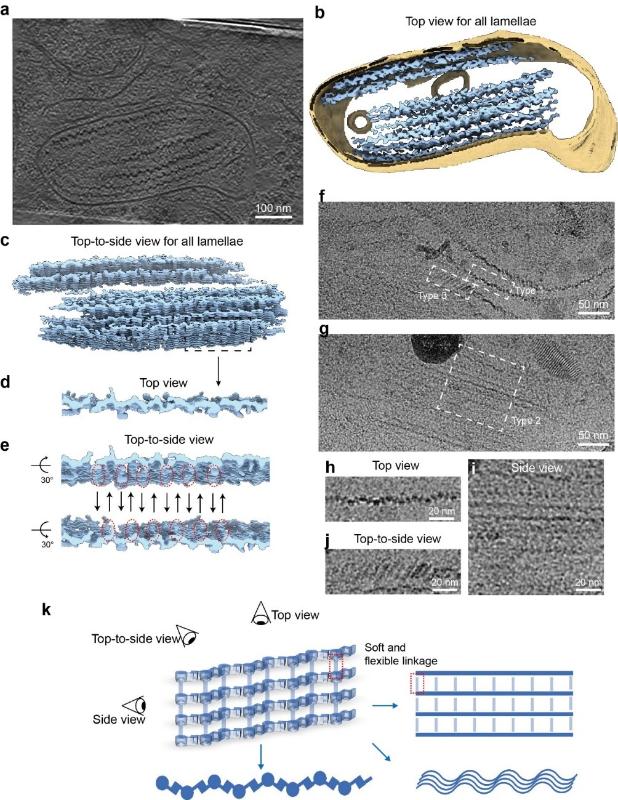
在本研究中,团队采用 FIB-milling 结合 cryo-ET,对细胞及黑色素体进行冷冻电镜断层成像。重建结果清晰显示,在黑色素体腔内存在多张沿内膜弯曲延展的片状结构,其内部由等间距平行排列的纤维构成,证实 PMEL 在细胞内确实组装为高度有序的三维片层,而非简单的纤维聚集物。
随后,作者从黑色素瘤细胞中提取PMEL聚集体,通过冷冻电镜数据分析,发现存在三类反复出现的条带组装体结构:第一类颜色较深且有周期,第二类颜色较浅且平行排列,第三类介于中间。通过进一步分析,研究团队提出假设:这三种形态可能分别对应 PMEL 片层的“俯视图”、“侧视图”和“斜视图”,提示黑色素体内部存在连续弯曲的纤维片层结构。
在对PMEL纤维片层进行定性分析后,研究者尝试解析其高分辨结构。由于 PMEL 以片层形式存在,传统“单根螺旋纤维”的处理策略并不适用,研究团队建立了针对片层样本的混合数据处理流程:在片层中抽取单条纤维片段作为颗粒进行 2D / 3D 分类与重构,同时在重构过程中保留相邻纤维信息,以反映片层内的真实堆砌关系。
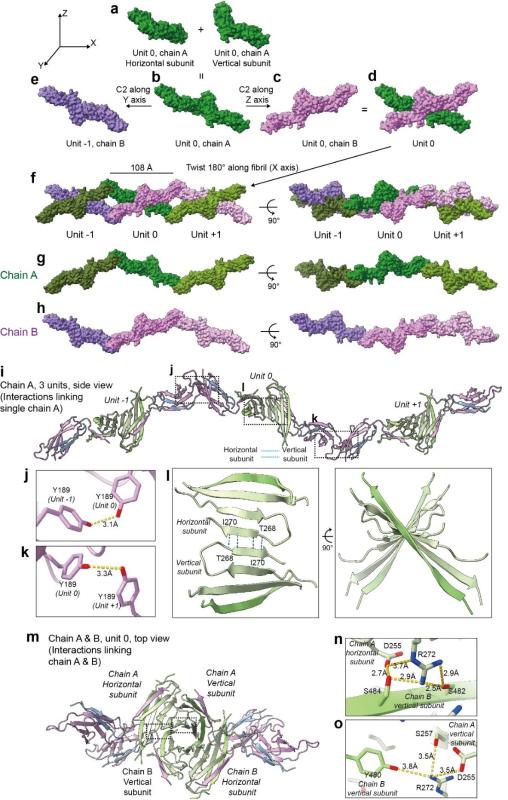
最终,作者获得了整体分辨率约 4.9 Å 的片层结构模型以及分辨率约为3.5 Å 的纤维结构模型。结构显示:
• 每条 PMEL 纤维由重复的“蝴蝶状”结构单元沿轴向周期堆叠而成,重复周期约为 108 Å;
• 单个“蝴蝶单元”由两条高度相似的多肽链(Chain A & Chain B)组成,彼此呈 C2 对称排列;
• 每个“蝴蝶单元”的亚单元Chain包含两个PMEL蛋白分子(Horizontal subunit & Vertical subunit),二者通过β-sheet相结合;
• 在更高层级上,纤维内部、沿轴向的单元重复,以及片层中相邻纤维之间,依次形成三层 C2 对称关系,构成稳定而有序的片层框架。
与经典病理性淀粉样纤维不同,PMEL 的纤维核心并非单一短肽以 cross-β 方式无限堆叠,而是由多个折叠良好的结构段共同参与,形成“折叠结构域 + 局部淀粉样 β 片层”相结合的新型骨架。
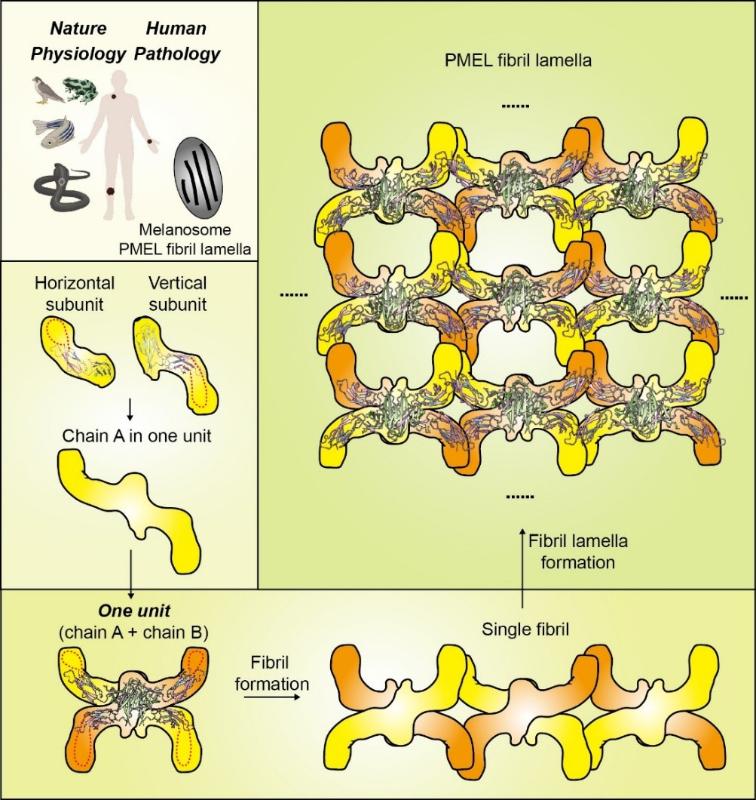
总体而言,这项工作将原位冷冻电镜断层成像与高分辨率冷冻电镜重构技术相结合,实现了对黑色素体内功能性淀粉样片层的多尺度解析,展示了从细胞器到原子层面的完整结构链路。。对于关注淀粉样蛋白组装、细胞器生物发生以及相关疾病机制的研究者而言,这项工作不仅提供了重要的结构基础,也树提供了一套值得借鉴的研究范式。
本研究由上海交通大学Bio-X研究院李丹教授、中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究员、及复旦大学附属肿瘤医院陈勇教授担任共同通讯作者。中国科学院上海有机化学研究所生物与化学交叉研究中心博士后马博远、上海交通大学Bio-X研究院博士研究生姚语萱、中国科学院上海有机化学研究所生物与化学交叉研究中心博士研究生董辉和复旦大学附属肿瘤医院杨琳丽老师为共同第一作者。本研究还得到了上海科技大学生命科学与技术学院孙博研究员的支持。
论文链接:https://www.nature.com/articles/s41467-025-65221-0