
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大沈琦课题组发文:仿生二茂铁纳米粒诱导双重铁死亡增强免疫治疗
近期上海交通大学药学院沈琦团队在《Journal of Controlled Release》发表题为 “Outer membrane vesicle-coated ferrocene nanoparticles induce dual ferroptosis for cancer immunotherapy” 的研究。本研究首次构建了外膜囊泡包覆的仿生二茂铁纳米颗粒 FMV@PCFPC,通过协同作用,诱导双重铁死亡,为抗肿瘤免疫治疗策略提供了新的范式。

具核梭杆菌(Fn.)作为一种常见的肿瘤内厌氧菌,可分泌毒力因子抑制 CD8⁺ T细胞的杀伤功能,减少免疫细胞浸润,促进乳腺癌进展。现有治疗手段中,抗生素易引代谢紊乱与细菌耐药,而靶向肿瘤的纳米药物难以同时作用于细菌与肿瘤细胞,治疗效果受限。因此,打破肿瘤内免疫抑制环境,成为提升乳腺癌治疗效果的关键。
在本研究中,作者设计的FMV@PCFPC 系统通过多组分协同实现 “靶向递送-双重铁死亡-免疫激活” 的完整治疗链,其各组分的作用如下:① 肿瘤靶向优势:FMV 是Fn.分泌的天然囊泡,表面富含特异性黏附蛋白可与乳腺癌细胞表面的黏附受体结合,实现肿瘤组织的精准靶向。 ② 双重铁死亡诱导:纳米粒子中的二茂铁作为稳定的Fe²⁺供体通过芬顿反应生成·OH,为肿瘤及瘤内菌的双重铁死亡提供 “燃料”;肉桂醛可通过迈克尔加成反应与GSH结合,降低肿瘤细胞与细菌内的 GSH 水平,解除铁死亡抵抗;同时,肉桂醛可直接破坏细菌细胞膜、抑制生物膜形成,与Fe²⁺协同增强抗菌效果。 ③ 高效免疫激活:FMV携带脂多糖(LPS)等病原体相关分子模式(PAMPs),促进DC成熟与细胞因子分泌,增强免疫应答。同时肿瘤铁死亡会引起免疫原性细胞死亡(ICD),激活DC细胞并促进抗原呈递,从而诱导特异性T细胞反应,最终形成持久的抗肿瘤免疫记忆。
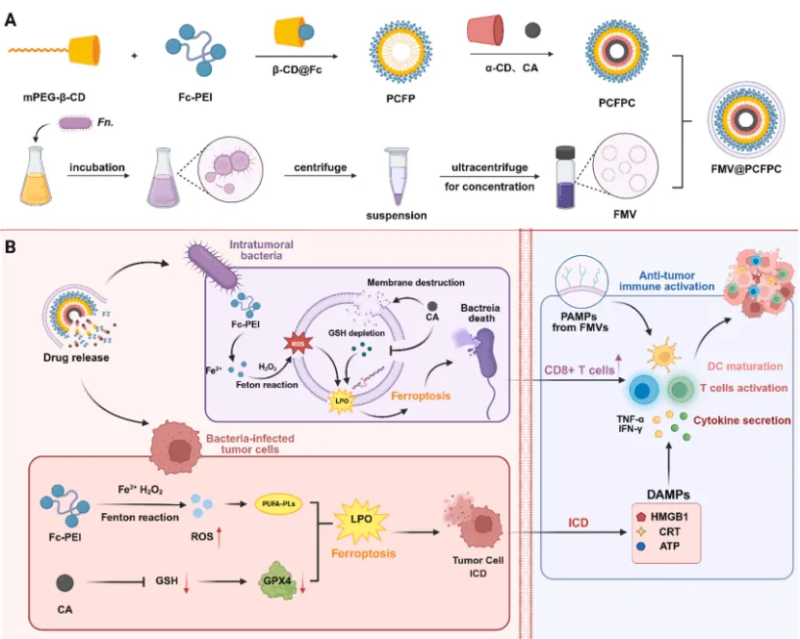
图1 FMV@PCFPC的制备示意图及免疫激活机制图
总结而言,本研究首次构建了外膜囊泡包覆的仿生纳米颗粒 FMV@PCFPC,通过协同作用,实现了通过双重铁死亡高效清除肿瘤及瘤内细菌,为解除肿瘤免疫抑制提供了新思路。
本研究第一作者为上海交通大学药学院硕士研究生沈子棋,通讯作者为沈琦研究员。
论文链接:https://doi.org/10.1016/j.jconrel.2025.114203