
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大李保界课题组与合作者揭示局部维生素D代谢缺陷是瓣膜钙化的“隐形杀手”
钙化性主动脉瓣疾病(CAVD)是一种常见疾病,影响了全球约1260万人,其特征为主动脉瓣瓣膜的增厚和矿化,最终会导致心力衰竭。衰老、高胆固醇和磷钙代谢失调是主要的风险因素。CAVD的发病机制与瓣膜间质细胞(VIC)和/或内皮细胞(VEC)的增殖及成骨分化密切相关。然而,由于VICs和VECs的异质性,目前尚不清楚哪些亚群的VICs或VECs是导致CAVD发展的根本原因。此外,VIC或VECs向成骨细胞转分化的分子机制仍未被完全阐明,且该疾病目前缺乏有效的药物治疗手段。因此,深入探究CAVD的发病机制对于开发新的治疗策略具有至关重要的意义。

2025年10月13日,上海交通大学Bio-X研究院李保界课题组与陆军军医大学陈林课题组共同在Advanced Science发表题为“The pathogenic roles of local vitamin D metabolism defect in valve inflammation and calcification”的研究论文,该研究使用高磷饮食诱导的瓣膜钙化模型,结合谱系示踪与单细胞测序分析技术,首次发现Prrx1⁺Acta2⁻VIC亚群主导瓣膜钙化,阐明了高磷饮食抑制瓣膜中维生素D代谢,进而促进炎症和VIC成骨分化的分子机制。活性维生素D (1,25(OH)2D)而非普通维生素(Vitamin D)能够有效抑制炎症并减轻瓣膜钙化。本研究揭示了瓣膜钙化的细胞和分子基础,发现活性维生素D作为一种预防CAVD的潜在药物,为未来的研究和临床应用开辟了新的道路。
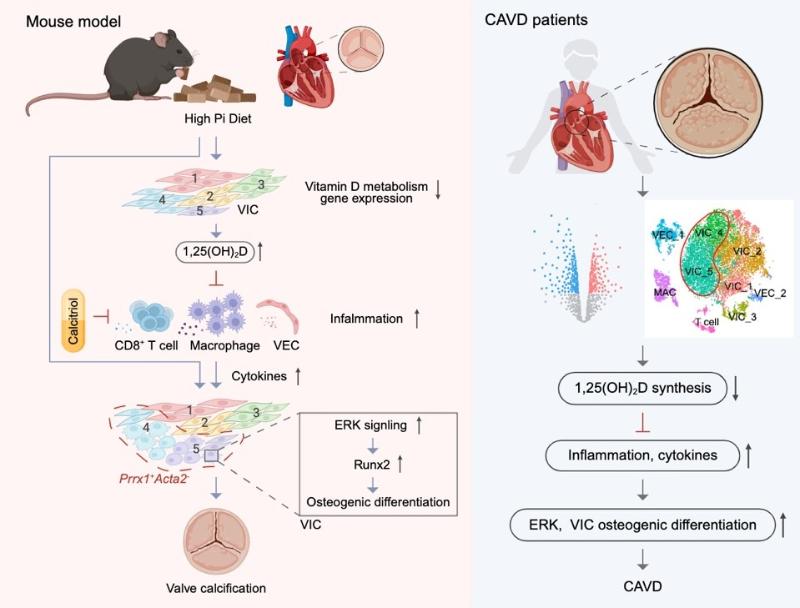
研究团队发现,高磷酸盐水平会抑制维生素D代谢基因的表达,特别是在VICs中,从而降低1,25(OH)2D的水平。这会引发涉及CD4-CD8⁺ T细胞、Prox1⁺淋巴内皮细胞和巨噬细胞的炎症因子水平增加,这些炎症因子与磷酸盐离子共同作用,激活ERK信号通路,诱导Prrx1⁺Acta2⁻ VICs的两个亚群发生成骨分化,最终导致瓣膜钙化。补充活性维生素D能够预防高磷饮食引发的瓣膜钙化和炎症。更为重要的是,CAVD患者的瓣膜中也存在向成骨分化的VIC亚群、维生素D代谢及应答基因表达的抑制以及炎症等类似的病理变化。总之,本研究确定了由高磷酸盐血症诱导的瓣膜钙化的特定VIC亚群,阐明了驱动VIC成骨分化的分子途径,为CAVD的诊断和治疗提供了新的思路,并提出活性维生素D作为CKD患者预防CAVD的潜在治疗方法。
该研究获得了国家重点研发计划,国家自然科学基金,上海市自然科学基金的支持。
论文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202501250