
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大贺光课题组与合作者发现原发性小头畸形新致病基因
原发性小头畸形(Primary Microcephaly)是一种严重的神经发育障碍,多发生于妊娠32周前的胚胎神经发生关键期,患儿头围在出生时即显著小于正常范围,并伴有不同程度的智力障碍、额外的神经问题(如癫痫发作)以及视力或听力受损。
近日,上海交通大学Bio-X研究院贺光课题组与国家卫健委出生缺陷重点实验室、同济大学及美国犹他大学等全球27家机构合作,在《The Journal of Clinical Investigation》在线发表题为“Mutations in spliceosomal gene SNW1 cause neurodevelopment disorders with microcephaly”的研究成果。该研究首次揭示剪接体基因SNW1突变导致伴小头畸形神经发育障碍的分子机制,为SNW1相关疾病的基因诊断与遗传咨询提供了科学依据,深化了对剪接体调控神经发育的理解,也为靶向治疗策略开发奠定了理论基础。
研究团队通过国内外多中心合作,检出9个以严重小头畸形为突出表现的神经系统发育障碍性疾病患者携带SNW1新发突变,这些突变通过破坏SNW1蛋白与PPIL1/PRPF8等剪接体核心成分的相互作用,进而影响剪接体的动态组装与催化活性。为了进一步阐明相关致病机制,研究团队构建了果蝇模型,敲除SNW1同源基因导致神经干细胞增殖减少80%、脑体积显著缩小;在人脑类器官模型中,利用SNW1杂合敲除iPSCs培育的类器官,重现神经元前体细胞增殖区面积缩减40%、凋亡率倍增的疾病表型。结合SNW1在人类胚胎及小鼠胎儿脑中的时空特异性表达,提示SNW1在神经发生早期阶段通过双重机制维持神经干细胞池的平衡,而不是在成熟神经元中。进一步的转录组学分析发现,在SNW1杂合敲除的45天人脑类器官中发生的差异性剪接事件中,外显子跳跃事件(Skipped exon, SE)占主导地位。分析发现,这些事件显著富集于长转录本和多异构体基因,并导致下游关键神经发育基因的异常剪接,如CENPE、MEF2C、NRXN2等。这些剪接缺陷通过RT-qPCR得到验证,且与基因表达失调显著相关。SNW1敲除导致的剪接紊乱可能导致剪接同工型之间比例的改变,尤其富集于长转录本和多异构体基因,这与大脑发育中长基因和多可变剪接不谋而合,将剪接保真性与神经发育通过SNW1直接关联(图1)。
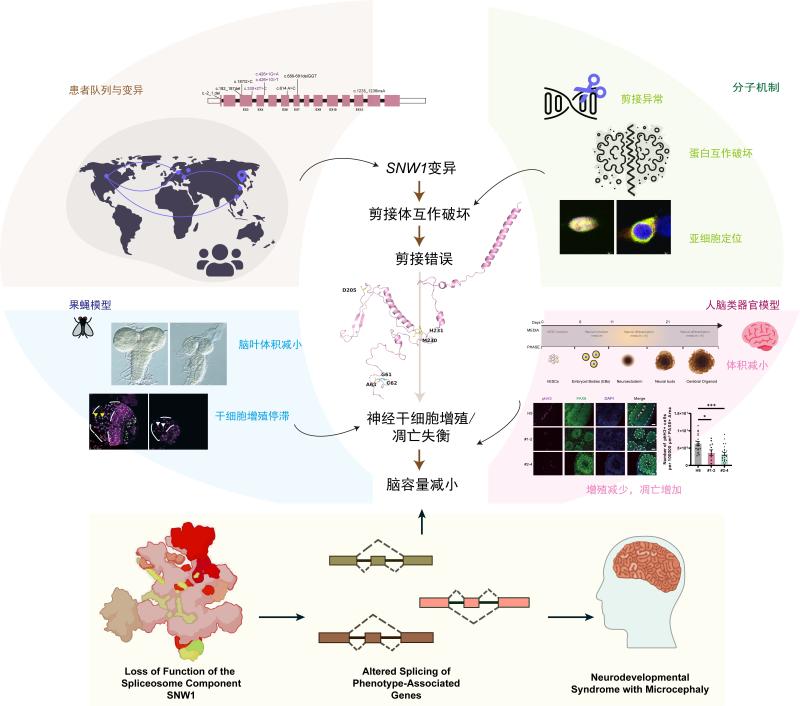
图1. SNW1 变异影响剪接体动态组装导致小头畸形发生的分子机制模式图
综上,本研究首次发现SNW1是原发性小头畸形的新致病基因,这项突破性研究不仅揭示RNA剪接紊乱在神经发育疾病中的核心作用,更为相关神经系统疾病的治疗研究开辟了新方向。上海交通大学Bio-X研究院吉雷博士、同济大学研究生严瑾和美国犹他大学Nicole A.Losurdo博士为本文的共同第一作者。本研究获得国家重点研发计划、国家自然科学基金、多个省市科研项目及上海交通大学“交大之星”计划医工交叉研究基金支持。
论文链接:https://doi.org/10.1172/JCI186119