
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大商明团队通过铜催化的(硫代)磷酸二氯化物去对称化反应实现磷(V)手性化合物的模块化合成
近日,上海交通大学变革性分子前沿科学中心商明团队在期刊Angew. Chem. Int. Ed上发表了题为“Modular Access to P(V)-Stereogenic Compounds via Cu-Catalyzed Desymmetrization of (Thio)Phosphonic Dichlorides”(通过铜催化(硫代)膦酰二氯的去对称化实现磷(V)手性化合物的模块化合成)的最新研究成果。
商明课题组(www.shangchemlab.com)致力于手性核苷酸分子的高效合成、结构修饰及其在核酸药物开发中的应用研究。在前期发展的铜催化不对称合成核苷ProTide前药(J. Am. Chem. Soc. 2024, 45, 31339)以及核酸修饰研究(Angew. Chem. Int. Ed. 2025, e202500744; Angew. Chem. Int. Ed. 2024, e202418806)基础上,该课题组进一步设计构建了基于廉价铜的手性路易斯酸催化体系,成功实现了(硫代)磷酰二氯化物的对映选择性去对称化反应,模块化地构建了含多种P–杂原子键的P=O与P=S骨架。该方法为包括手性硫代二核苷酸在内的多类磷中心手性核苷酸分子的立体选择性合成提供了高效实用的新策略。
手性磷(V)中心在核酸治疗、手性催化与功能材料等领域中发挥着日益重要的作用。尽管近年来在构建含手性C–P键的磷骨架方面取得了显著进展,但全杂原子取代的P(V)化合物的立体选择性合成仍面临重大挑战。这类结构广泛存在于多种生物活性分子中,其中P中心的绝对构型对靶点识别与药效具有决定性影响(图1a)。传统构建P–杂原子键的方法主要依赖亲核取代反应。近年来,催化不对称合成策略的兴起为构建磷(V)立体中心提供了新思路,特别是在ProTide前药合成中,催化动力学拆分与动态动力学拆分等策略(如图1b)已成功实现P-手性骨架的构建。例如,张万斌团队通过开发双环咪唑类有机碱催化剂,立体选择性合成了瑞德西韦药物分子(Tetrahedron: Asymmetry 2012, 23, 329; Angew. Chem. Int. Ed. 2020, 59, 20814)。Jacobsen课题组和Dixon小组利用有机小分子催化的去对称化策略,通过P(V)中心的连续立体选择性亲核取代反应,提供了构建复杂分子结构的有效平台。然而,这些方法仍主要局限于含C–P键的底物体系。尤其值得关注的是,全杂原子取代的P=S结构的立体构建研究至今十分有限,它能作为P=O结构类似物显著调节核苷酸分子的生物活性。最近,李光勋/唐卓团队与何智涛团队分别报道了使用有机小分子催化剂实现了苯酚衍生磷酰二氯的去对称化反应,成功合成了对映纯的全杂原子取代P(V)=O化合物。Vy M. Dong课题组也利用钇催化剂与冯氏配体组合,实现了非手性噁唑啉酮磷酰二氯与苯酚之间的对映选择性亲核取代反应构建P(V)=O化合物。
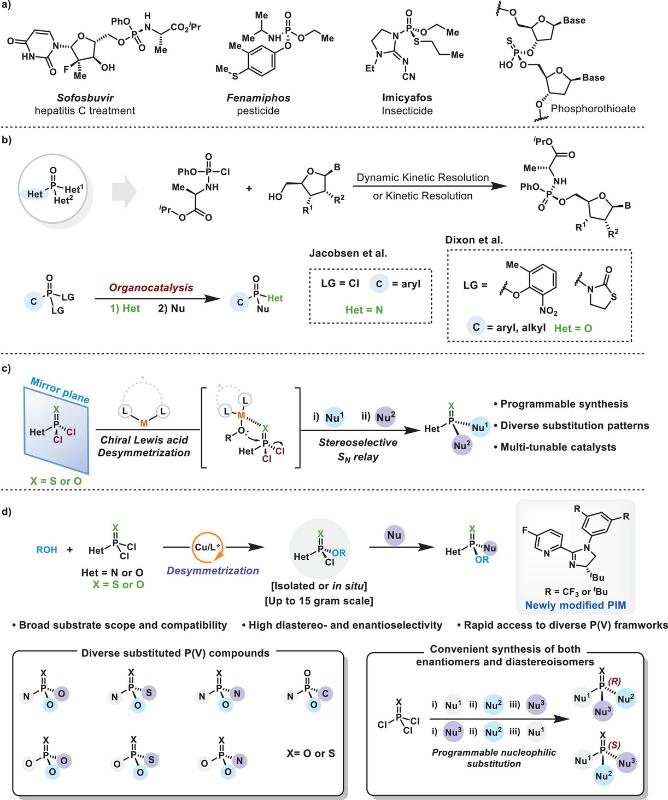
图1:背景介绍及本文工作
商明团队首先以2′,3′-O-异丙叉尿苷(1a)为模型底物,与磷酰胺二氯化物(2a)反应,并加入苯酚钠作为第二个亲核试剂(表1)。在多种双齿和三齿配体中,2-吡啶基咪唑啉(PIM)配体表现最佳, Cu(hfac)₂是最佳催化剂,NEt₃是最佳碱。通过对PIM配体的结构优化,引入3,5-三氟甲基苯基(L17)和5-氟吡啶基(L18)显著提高了反应的立体选择性和产率。最终,(S)-L18配体在标准条件下实现了93%的产率和>99:1的d.r.。控制实验表明,催化剂和配体在反应中起着关键作用,且通过调整配体的手性和铜催化剂的种类,可以实现两种(Rp)和(SP)构型P(V)立体异构体的选择性合成。
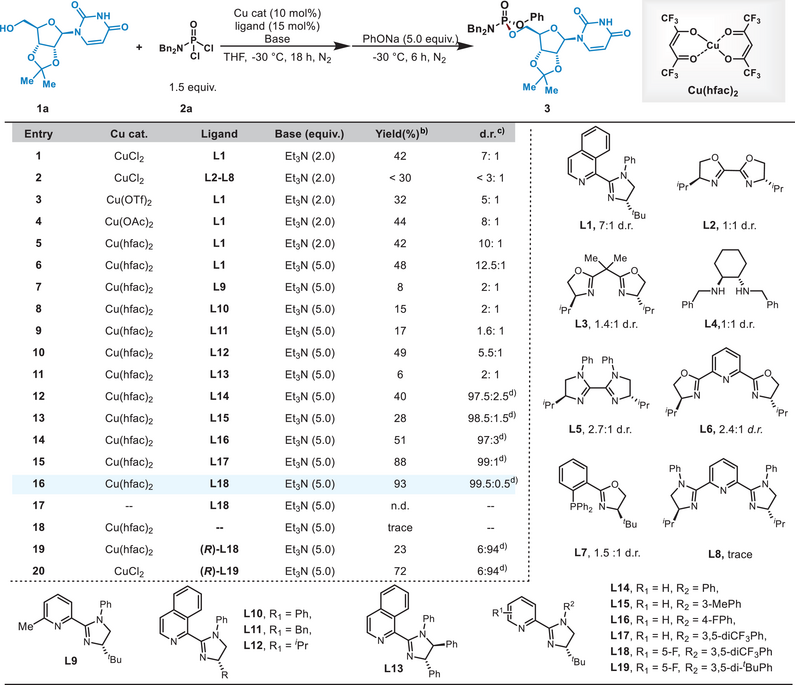
表1:反应条件优化
在优化条件下,研究团队对一系列磷酰胺二氯化物和核苷底物进行了广泛的底物拓展。结果显示,该方法对多种含敏感官能团或药物结构相关的胺基膦酰二氯底物具有良好的适用性(图2)。对于核苷底物,该方法不仅适用于保护的核苷、修饰核苷类似物和脱氧核苷,还能够实现核苷3′-OH的立体选择性膦酰化。此外,该方法还成功应用于多种糖类底物和非手性醇的不对称膦酰化,获得了优异的对映选择性(图3)。将催化剂和配体的量减半,对反应的产率和立体选择性几乎无影响。
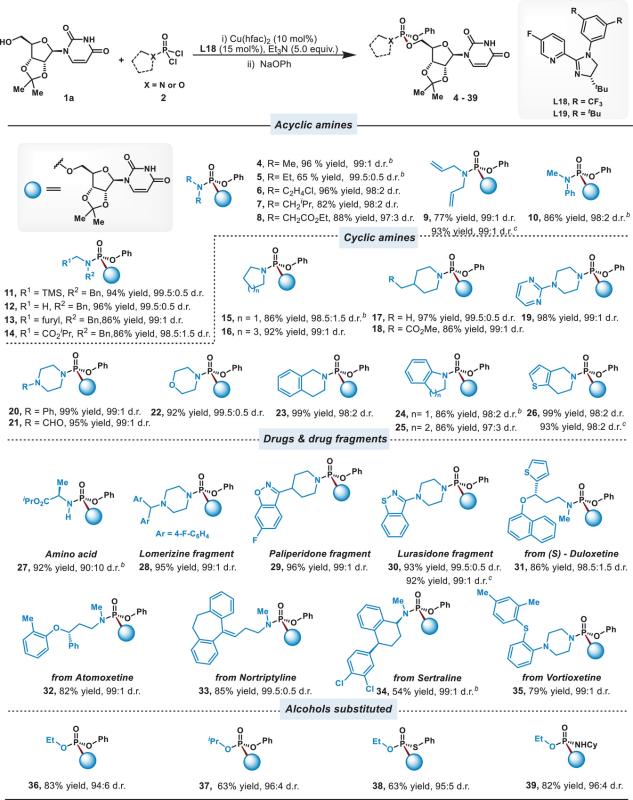
图2. 胺基膦酰二氯的底物拓展
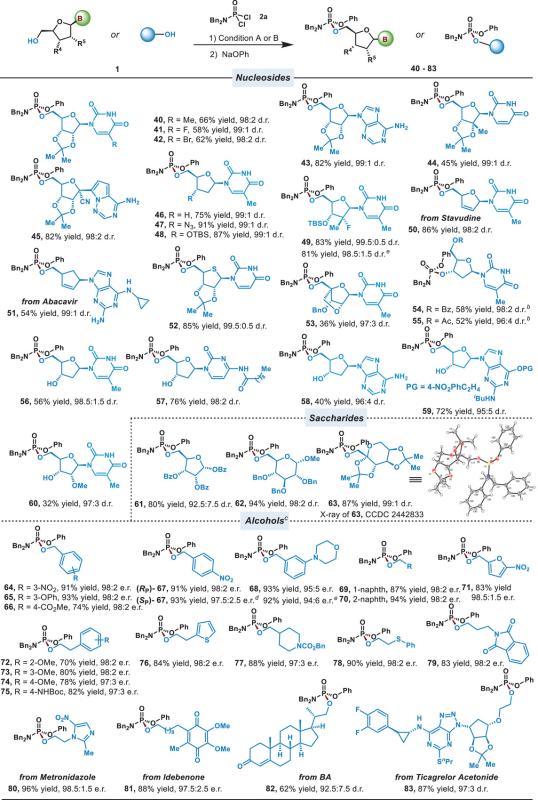
图3.亲核试剂底物的拓展
对于硫代膦酰二氯,使用更为低廉的CuBr,-10℃可同样高效地合成多种硫代膦酰单氯产物(图4)。
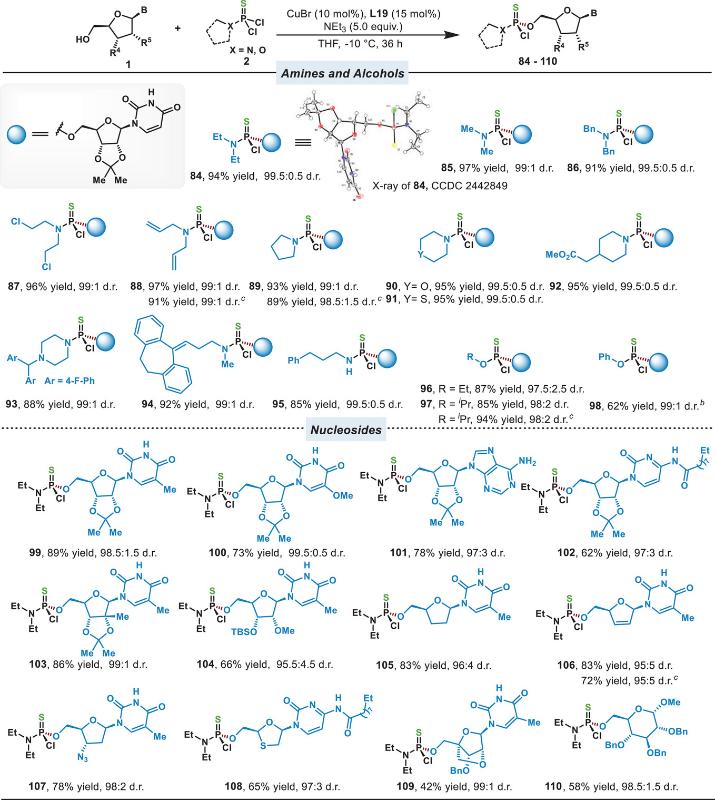
图4. 手性硫代膦酰氯的合成
随后,该研究团队进一步探索了该方法的实用性(图5)。仅使用5mol%的催化剂可实现15克规模的磷酰单氯中间体111的分离合成,该中间体与多种亲核试剂(如醇盐、酚盐、硫醇盐和胺)进行立体专一性亲核取代反应,生成了一系列立体化学富集的核苷P(V)化合物。该方法同样可实现硫代膦酰单氯的大规模合成并与另一分子核苷3’-OH反应立体选择性构建3’,5’-硫代二核苷酸。该方法还成功实现了P(V)化合物的立体发散性合成以及ICF05016的前体的不对称合成。
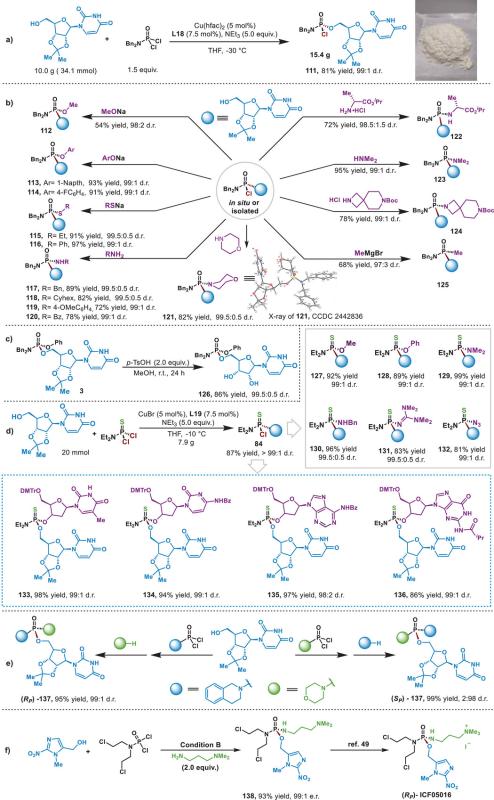
图5. 合成应用与转化
小结
商明课题组发展了一种新型Cu/PIM催化体系可实现核苷P(V)=O/P(V)=S手性中心的高效构建,底物适用范围广泛,兼容核苷、糖以及非手性醇类等130余种结构,并成功应用于手性硫代二核苷酸,ProTide前药等治疗核酸分子的高效合成。反应具有规模化优势,仅需较低催化剂负载即可完成15克规模的合成。另外该方法可选择性获得两种构型的P-立体异构体,为P(V)手性中心的构建提供了通用平台。鉴于全杂原子取代P(V)-核苷化合物在药物开发中的关键作用,这一策略将有力推动核酸药物开发等领域的进展。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202509807