
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大申涛团队实现芳香烃中苄位C(sp³)-C(sp³)键的电氧化胺化反应
近日,上海交通大学变革性分子前沿科学中心申涛副教授团队在Nature Communications上发表题为“Electro-oxidative Amination of Benzylic C(sp³)-C(sp³) Bonds in Aromatic Hydrocarbons”的研究成果。本研究采用腈类、酰胺及磺酰胺等氮亲核试剂,在无金属催化剂和外加氧化剂的温和条件下,成功实现了惰性C(sp³)-C(sp³)键的高选择性断裂与胺化,反应仅以氢气作为副产物。机理研究表明,该反应通过芳基苯类底物的阳极氧化断裂生成两个关键碳正离子中间体,随后被氮亲核试剂捕获形成两分子C-N键。值得注意的是,六氟异丙醇(HFIP)通过精准调控底物与产物的氧化电位差异,有效解决了电化学氧化中常见的产物过度氧化的难题。该研究实现了非张力环类烷基苯类化合物中惰性C(sp³)-C(sp³)键的高区域择性和化学选择性胺化,为胺类化合物的绿色合成、药物分子后期修饰以及聚合物/生物质降解等领域提供了创新性解决方案,展现出显著的科学价值与广阔的应用前景。
脂肪族C-H和C-C键作为有机分子中最基础的化学结构单元,其选择性活化与官能化始终是有机合成化学领域最具挑战性的研究方向之一。尽管近年来苄位C(sp³)-H键的直接官能化已取得突破性进展,但更为稳定的C(sp³)-C(sp³)键的活化/官能团化研究仍处于起步阶段(图1a)。这类化学键的精准活化在分子骨架编辑、功能高分子可控降解以及生物质资源转化等前沿领域展现出独特的价值,同时为发展绿色、高效的合成方法提供创新性策略。然而,针对无环芳烃体系(如二芳基乙烷类化合物)中高键能(~90 kcal/mol)的C(sp³)-C(sp³)键,如何实现高效、高选择性的活化转化仍存在显著挑战。虽然利用芳环自由基阳离子或阴离子中间体介导的芳香烷烃C(sp³)-C(sp³)键的氧化,羧基化等有少数报道,但烷基苯类底物C(sp³)-C(sp³)键的直接胺化反应仍面临多重挑战(图1b),如多个相似的碳碳、碳氢键的选择性活化,胺化产物由于更低的氧化电位易发生过度氧化降解等。
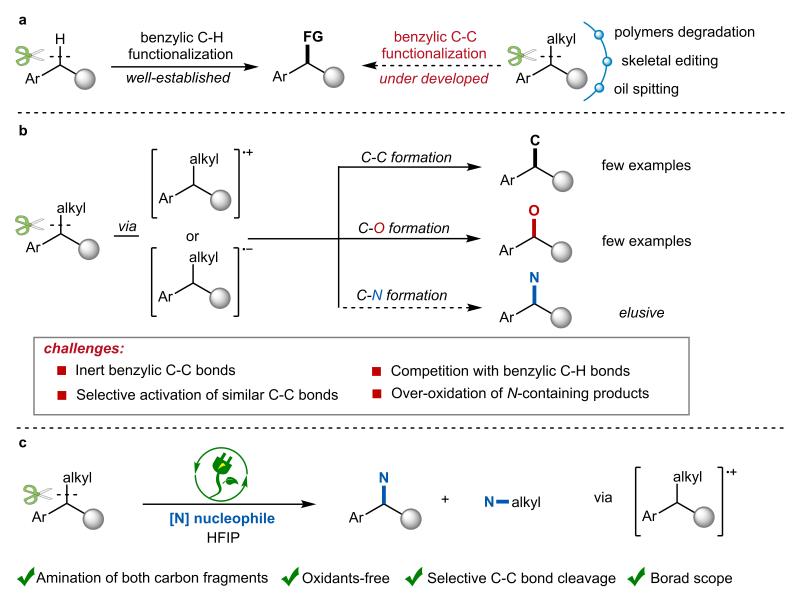
图1. 近年来苄位C(sp³)-C(sp³)键官能团化研究进展
基于以上难题,近期申涛课题组提出“HFIP介导的氧化电位调控机制”,在实现苄位C(sp³)-C(sp³)键高选择性活化同时,有效避免了胺化产物的过度氧化降解。其创新性主要体现在:(a)通过单次C-C键断裂实现双重C-N键构建(原子利用率达200%),反应生成的两个碳正离子中间体均能高效被亲核试剂捕获,不仅实现了分子效率的最大化,还避免了副产物的生成。 (b) 无外加氧化剂,仅产生氢气副产物;(c) 苄位C(sp³)-C(sp³)键的高选择性断裂;(d) 优异的底物普适性、反应稳定性、空气/水兼容性及放大合成可行性;(e) 可高效合成高附加值胺类产物(图 1c)。
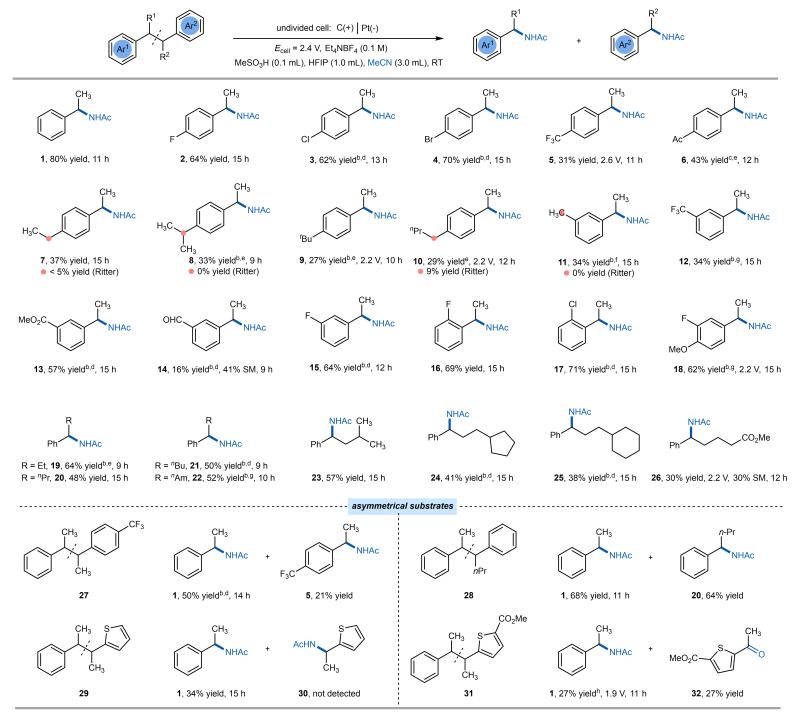
图2. 双苄基底物的电氧化C-C键胺化
研究团队以2,3-二苯基丁烷(S1)作为模板反应底物,对反应条件进行优化,在2.4 V恒压条件下,采用乙腈与HFIP的混合溶剂体系,以四乙基四氟硼酸铵作为电解质,甲基磺酸作为酸,最终以80%的分离收率实现C-C键的选择性断裂/胺化。在最优条件下,系统地考察了反应底物的兼容性,发现对称结构的2,3-二苯基丁烷及其卤代、醛基等衍生物均能有效转化,其中C-C键胺化显示出良好的选择性优势(图2)。竞争性实验表明,在支链底物中C-C键断裂是热力学和动力学双重优势路径,而线性底物则存在少量C-H胺化副反应。尽管富电子底物因高活性易产生过度氧化和分解,导致收率适中,但该体系仍展现出良好的官能团兼容性。
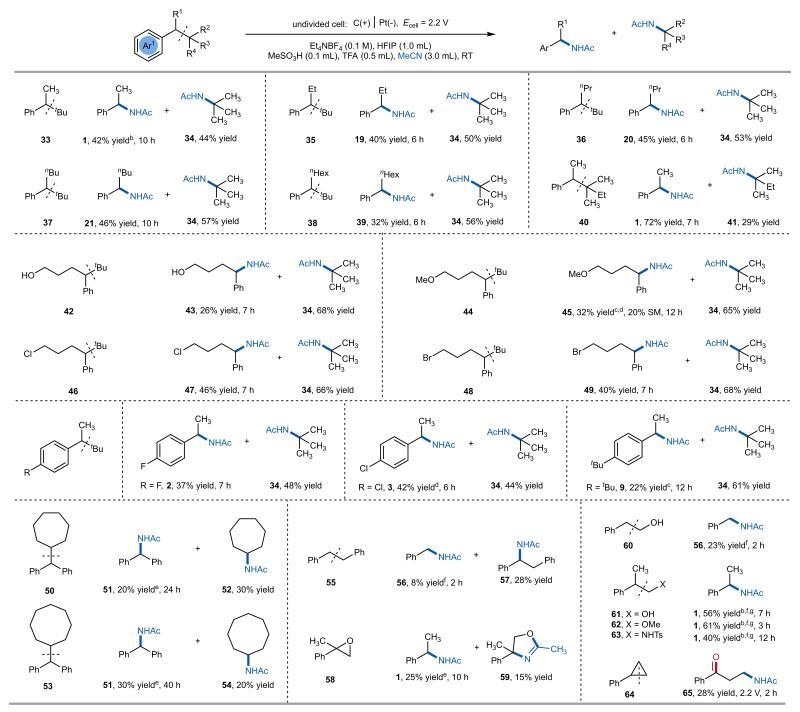
图3. 非活化烷基苯的电氧化C-C键胺化
除二苄基活泼底物外,该电化学体系还能高效活化含有苄位大位阻烷基的惰性底物,这些大位阻基团通过稳定断裂后的正离子或自由基,显著降低了C(sp³)-C(sp³)键的解离能,进而促进底物断裂。研究证实,α-甲基新戊基苯等多种新戊基苯衍生物均可发生选择性断裂,其中位阻更大的叔丁基位点反而展现出更优的反应性(图3)。该方法对该方法对伯醇、甲基醚、烷基氯和溴等多种氧化还原敏感基团表现出良好兼容性。此外,多种腈类及磺酰胺类、恶唑烷酮、氨基甲酸酯等氮亲核试剂及氧亲核试剂均展现良好兼容性(图4)。
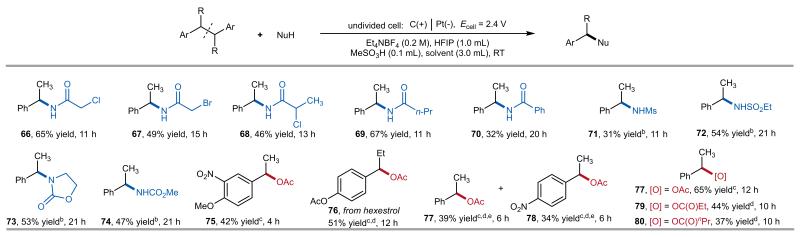
图4. 亲核试剂的范围
该C-C键胺化反应成功实现了克级规模放大(图5),通过放大电极材料尺寸并延长反应时间完成规模化制备。
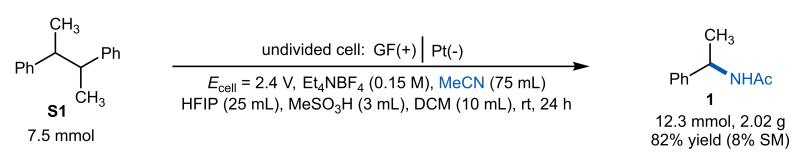
图5. 化合物1的克级规模合成
基于中间体验证及循环伏安实验,我们提出了可能的反应机理(图6e)。在阳极,芳基烷烃A发生单电子氧化生成自由基阳离子B,随后根据两个断裂片段氧化电位的相对高低,可通过两种途径进行β-C-C键断裂:均裂形成苄位碳正离子C和自由基E,或异裂生成苄位自由基C'和物种E'。无论β-C-C键断裂采取何种模式,自由基中间体C'和E都会在阳极发生快速二次氧化,最终形成碳正离子C和E'。这些碳正离子随后经历经典的Ritter反应历程,生成酰胺产物D和F。当使用磺酰胺、酰胺或羧酸等亲核试剂时,则形成相应的亲核试剂捕捉产物。同时,阴极发生析氢反应平衡了整个氧化还原过程。HFIP的重要性在于可与产物中酰胺的N原子形成分子间氢键,进而“钝化”底物。同时,HFIP可有效稳定自由基阳离子中间体,显著降低底物的氧化电位。
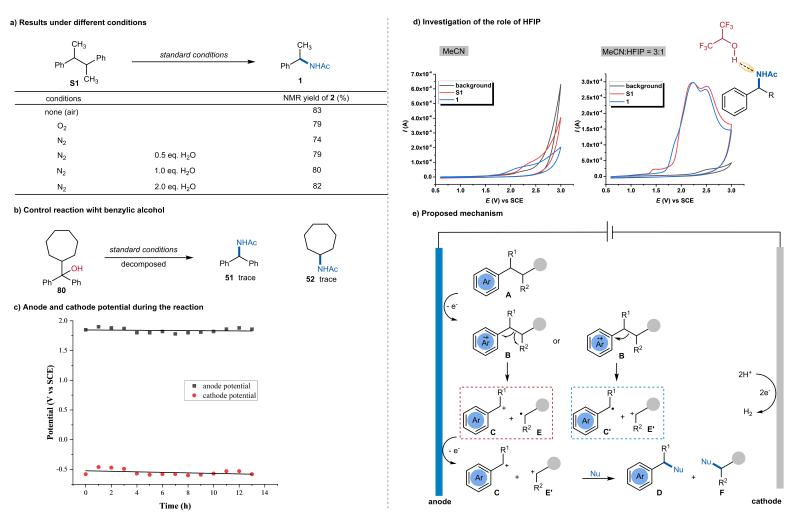
图6. 机理研究与反应机理推测
综上,上海交通大学变革性分子前沿科学中心申涛团队成功开发了一种温和条件下的电化学氧化诱导的苄位C(sp³)-C(sp³)键胺化反应,该反应无需外加氧化剂或过渡金属催化剂,实现了苄胺类化合物的高效、可放大合成,展现出优异的亲核试剂兼容性,为基于简单原料的可持续C-C键官能团化提供了创新性解决方案,在合成化学领域具有重要应用价值。
该研究成果以“Electro-oxidative Amination of Benzylic C(sp³)-C(sp³) Bonds in Aromatic Hydrocarbons”为题发表于Nature Communications。上海交通大学变革性分子前沿科学中心申涛副教授为论文通讯作者,上海交通大学博士生杨凯旋为第一作者。本研究得到了国家自然科学基金(22301179, 22471156)、中央高校基本科研业务费专项资金(23X010301599、24X010301678)、上海交大2030计划 (WH510363003/014), 小米青年学者等资助。
论文链接: https://www.nature.com/articles/s41467-025-61017-4
导师介绍
申涛,上海交通大学变革性分子前沿科学中心长聘教轨副教授,PI,博士生导师,入选国家和上海市高层次人才计划,上海交通大学“2030计划”。 荣获Thieme Chemistry Journals Award,教育部自然科学一等奖,中国新锐科技人物杰出成就奖,“上海科技青年35人引领计划”,小米青年学者,NHU-CJC Innovation Award等荣誉,担任Chinese Chemical Letters 青年编委。课题组的研究方向主要集中在惰性键的选择性活化与重组,绿色合成化学等。热忱欢迎对有机合成化学,绿色合成化学的博士后和研究生加入!