
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大曹骎课题组与合作者揭示人胰腺中糖蛋白GP2纤维结构及其消化道蛋白酶环境适应机制
近日,上海交通大学Bio-X研究院曹骎课题组与新华医院张飞团队合作,在《PLOS Biology》发表了题为“Structure of human glycoprotein 2 reveals mechanisms underlying filament formation and adaption to proteolytic environment in the digestive tract”的研究成果。该研究首次通过冷冻电镜解析了人源糖蛋白GP2纤维的高分辨率(3.5 Å)结构,揭示了其ZP模块组装形成纤维核心的分子机制,并阐明了GP2通过N-糖基化修饰在蛋白酶富集的消化道中维持抗菌功能的关键策略,为肠道感染防御机制及新型抗炎疗法开发提供了重要理论依据。 
糖蛋白2(GP2)作为尿调节蛋白(UMOD)的旁系同源物,两者均通过高甘露糖N-糖基化识别细菌黏附素FimH,在泌尿和消化道中发挥抗菌功能。此前研究已知UMOD通过位于柔性分支结构域的糖基化位点结合病原菌,但该结构域易被蛋白酶切割,而经蛋白酶切除分支结构域的纤维核心不具有抗菌功能。然而,GP2由胰腺分泌后需在富含蛋白酶活性的消化道发挥功能,其在体内是否以纤维形式存在,以及如何耐受消化道的蛋白酶活性,一直是领域内未解之谜。
研究团队通过手术获取人胰腺组织,从中提取天然GP2纤维并解析其冷冻电镜结构(图1)。结果显示,GP2通过ZP模块(ZPN-ZPC结构域及连接区)形成与UMOD类似的锯齿状纤维核心,而其N端分支结构域(D10C和EGF样结构域)因高度柔性未参与纤维组装(图1)。
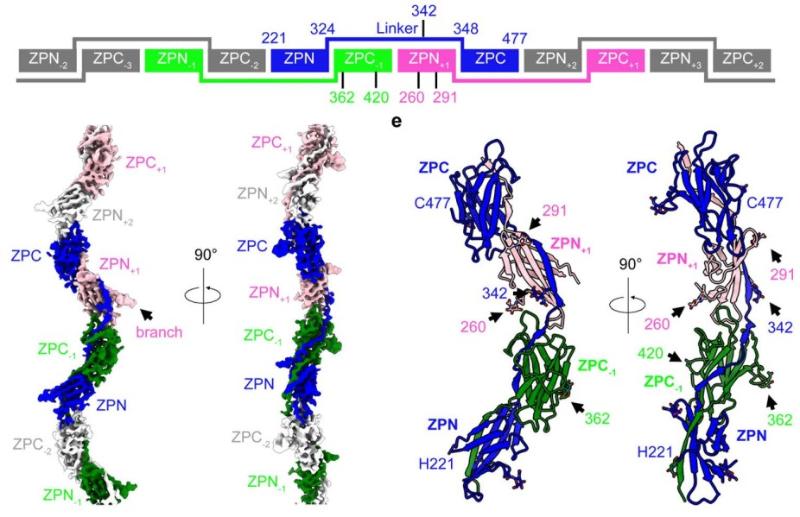
图1 论文报道的GP2纤维结构
蛋白酶耐受性实验表明,GP2分支结构域可被弹性蛋白酶切割,而其纤维核心区域保持完整。该结果提示GP2的抗蛋白酶机制可能由其纤维核心区域实现。因此,研究团队对于GP2的N-糖基化位点进行了质谱分析,结果显示GP2的分支结构域与纤维核心均存在高甘露糖修饰,因此可以保证在分支结构域被蛋白酶切除后,仅依靠纤维核心也可以行使抗菌功能。相对地,UMOD仅在分支结构域存在高甘露糖修饰,因此无法在蛋白酶环境中行使功能(图2)。这种“分支区域可弃,核心区域备份”的双保险策略,显示了GP2适应消化系统独特微环境的进化智慧。
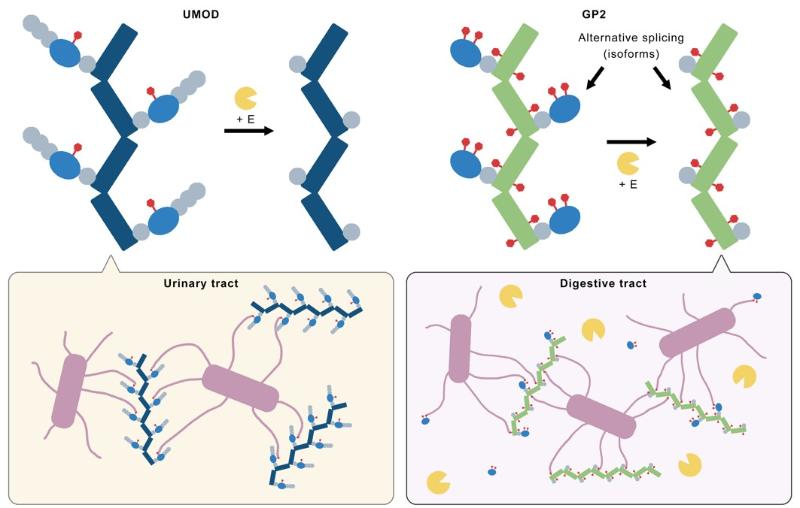
图2 论文提出的工作模型
该工作首次在分子层面解析了GP2纤维的结构与功能适应性机制,提出了GP2在消化道这一富含蛋白酶环境下保持功能的分子机制,弥补了分泌型ZP蛋白家族在多样化环境中的功能演化理论空白。上海交通大学Bio-X研究院博士后韩建为论文第一作者,新华医院张飞副主任医师与上海交通大学曹骎副教授为共同通讯作者。研究获得科技部“科技创新2030”重大项目(青年科学家项目)、国家自然科学基金面上项目、中国博士后科学基金、上海交通大学“交大之星”计划医工交叉研究基金支持。
论文链接:https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3003238