
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大李丹课题组与合作者发现渐冻人症致病蛋白TDP-43相分离相变调控的新机制
肌萎缩侧索硬化症(amyotrophic lateral sclerosis, ALS)是一种神经退行性疾病,其主要特征是大脑和脊髓中的运动神经元受损,最终导致进行性运动能力丧失。ALS 的发病机制复杂,近年来,研究重点逐渐聚焦于生物大分子凝聚体,特别是应激颗粒和 TDP-43 凝聚体在 ALS 中的作用。然而,这些凝聚体的理化性质及其调控机制尚未被充分揭示。Hippo 信号通路作为调控细胞增殖、分化和凋亡的重要通路,近年来被发现与多种神经退行性疾病密切相关。然而,该通路是否直接参与 ALS 相关应激颗粒和 TDP-43 凝聚体的动态调控,仍有待进一步研究。

2025年6月20日,上海交通大学Bio-X研究院李丹团队联合厦门大学生命科学学院王波课题组与郑燚明课题组在Nature Cell Biology杂志发表题为 “YAP maintains the dynamics of TDP-43 condensates and antagonizes TDP-43 pathological aggregates” 的研究论文。该研究揭示了Hippo信号通路核心效应分子YAP蛋白在ALS发病机制中的一种全新功能:YAP可直接与TDP-43相互作用,类似“分子伴侣”维持TDP-43凝聚体的动态流动性,从而抑制其病理性聚集。值得关注的是,YAP的这一保护作用并不依赖其经典的转录激活功能,为ALS潜在干预策略提供了全新思路。
研究首先从Hippo通路与应激颗粒的关联出发,发现YAP在细胞应激状态下能够促进应激颗粒的解聚,并且该功能独立于其转录激活活性。进一步通过蛋白互作网络分析,证实YAP可与TDP-43发生直接相互作用。机制研究表明,YAP通过其TEAD结合区结构域识别并作用于TDP-43的N端结构域,从而调控TDP-43凝聚体的动态平衡,并维持其凝聚态内部的液滴样流动性,进而有效防止细胞质中TDP-43凝聚体向病理性固化转变(图1)。在ALS患者大脑皮层神经元中,研究者观察到YAP与磷酸化的病理性TDP-43聚集体显著共定位。原代皮质神经元实验也验证了YAP对TDP-43介导的细胞毒性的拮抗作用。更为重要的是,在过表达人源TDP-43(hTDP-43)的ALS果蝇模型中,无论是YAP本身还是其果蝇同源物Yorkie的过表达,均能显著缓解TDP-43诱导的神经毒性表型,进一步支持了YAP在ALS中的神经保护功能。
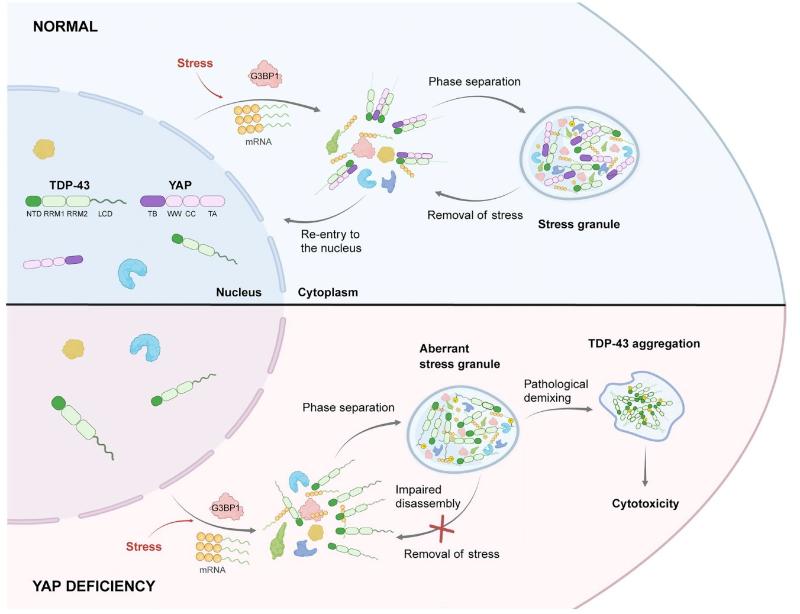
YAP调控TDP-43相分离稳态并抑制病理聚集模式图
综上,本研究首次揭示了Hippo通路核心分子YAP在调控蛋白质相分离及抑制病理性聚集过程中的全新功能,该功能独立于其传统的转录调控作用。在该过程中,YAP展现出类似“分子伴侣”或“流动性守护者”的作用,维持TDP-43凝聚体的动态性,防止其向病理性聚集体转变。在治疗策略层面,本研究带来了重要启示。长期以来,YAP因其促进细胞增殖的特性而被广泛视为癌症治疗中的潜在靶点,但提高其活性也常伴随着致癌风险。令人振奋的是,研究发现转录失活的YAP S94A突变体依然保留其神经保护作用,能够有效维护TDP-43凝聚体的流动性。这一发现成功地将YAP的“有益”功能(调控相分离、抑制病理聚集)与其“有害”功能(促进细胞过度增殖)解耦,为开发新型ALS等蛋白聚集相关疾病的治疗策略提供了新的思路。未来可望设计选择性激活YAP“伴侣功能”而不引发转录活性的靶向药物或基因疗法,实现更安全有效的疾病干预。
论文链接:https://www.nature.com/articles/s41556-025-01685-y