
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大王宏林团队发文揭示白癜风神经免疫新机制和治疗新策略
2025年6月16日,上海交通大学医学院附属第一人民医院王宏林教授团队在国际免疫学顶级期刊Immunity上发表了题为“Nociceptor-derived CGRP enhances dermal type I conventional dendritic cell function to drive autoreactive CD8+ T cell responses in vitiligo”的研究成果,揭示了白癜风中存在“感觉神经元-CGRP-cDC1-CD8+ T细胞”致病新机制;通过神经肽CGRP受体拮抗剂(瑞美吉泮,Rimegepant)阻断该神经-免疫互作轴,可显著抑制白癜风模型小鼠的疾病进展,并在57例白癜风患者的临床试验中展现出良好的治疗效果,为治疗白癜风提供了全新策略(图1)。

图1 研究成果于2025年6月16日在Immunity刊发
白癜风是一种慢性的、毁容性的自身免疫性皮肤疾病,其以黑素细胞受损而导致的局部或大面积的皮肤白斑为特征。截止目前,我国约有3000万白癜风患者;其中,超过50%患者20岁前发病,终身累及,难以治愈。白癜风病因复杂不明,临床靶向治疗药物奇缺。JAK抑制剂(鲁索替尼乳膏)为FDA批准的唯一用于治疗白癜风的药物1。,但该药物尚未在我国获批上市,目前我国的约3000万白癜风患者没有一个靶向治疗药物可用。
为解决白癜风靶向治疗药物奇缺的临床困境,上海交通大学医学院附属第一人民医院王宏林团队和杭州市第三人民医院许爱娥团队联合攻关,首先对正常和白癜风皮肤进行单细胞联合空间转录组学测序分析,首次发现白癜风皮损中存在常规Ⅰ型树突状细胞(cDC1)-CD8+ T细胞互作,且真皮cDC1特异性高表达CGRP受体CALCRL-RAMP1,提示白癜风真皮cDC1可能接受CGRP信号调控。
事实上,皮肤是一个非常复杂且高度协作的器官,包含多种神经纤维、免疫细胞及组织细胞。支配皮肤的神经从脊髓发出,细胞体处于背根神经节DRG中;其中,Nav1.8+/TRPV1+ 感觉神经可以深入到皮肤表皮层,通过分泌神经肽CGRP调控多种皮肤免疫反应,是皮肤免疫应答的控制者2-5。特别地,王宏林团队前期研究发现感觉神经通过CGRP介导银屑病,通过利多卡因靶向感觉神经能够有效治疗银屑病(JID, 2022)6;随后,进一步揭示了银屑病中TNC+ 真皮成纤维细胞亚群促进神经轴突异常增生及神经免疫互作的新机制,为炎性皮肤局部免疫微环境重塑提供了新的视角(Nature Communications, 2023)7。
结合白癜风真皮cDC1特异性高达CGRP受体,研究团队猜想:CGRP+ 感觉神经是否也参与白癜风发生发展?通过皮肤全包埋透明化成像技术,研究团队发现与正常皮肤相比,白癜风皮损中CGRP+ 感觉神经密度和真皮cDC1数量均显著增加,且二者在空间分布上彼此邻近,提示白癜风皮损中很可能存在“CGRP+ 感觉神经-真皮cDC1”相互作用(图2)。
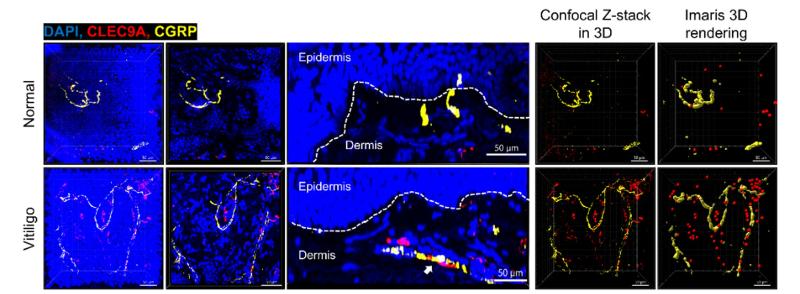
图2 白癜风皮损区CGRP+ 感觉神经密度和真皮cDC1数量均显著增加且二者空间邻近
接着,研究团队构建了高度类似于人类白癜风的小鼠模型,即黑素瘤细胞B16F10-CD4 Deletion诱导的白癜风小鼠模型。利用Nav1.8-tdTomato感觉神经荧光报告小鼠,研究团队发现Nav1.8+ 神经与CGRP+ 神经高度共定位,提示皮肤中CGRP主要来自Nav1.8+ 感觉神经;同时发现白癜风造模小鼠皮肤中CGRP+ 神经密度和真皮cDC1数量均增加, 与白癜风患者皮肤染色结果一致。
研究团队通过Nav1.8-tdTomato-DTR小鼠或树脂毒素RTX特异性消融感觉神经,结果表明神经剔除能够显著抑制白癜风造模小鼠疾病发展。为了进一步确定感觉神经来源CGRP是否真的对疾病发展至关重要,研究团队在神经剔除小鼠体内,外源性回补CGRP,结果发现小鼠白癜风疾病表型被显著恢复,从而得出结论:感觉神经及其分泌的CGRP调控白癜风造模小鼠的疾病发生发展。
在白癜风患者和小鼠模型中,研究团队均发现真皮cDC1数量显著增加。为进一步探究真皮cDC1在白癜风中的作用,团队构建了Xcr1-tdTomato荧光报告小鼠,用于cDC1 的标记和形态观察。结果发现,小鼠白癜风造模之后,真皮cDC1细胞形态从圆形变为树突状,说明其处于活化状态;同时,这些cDC1紧密缠绕着CGRP+ 神经纤维分布,提示二者存在相互作用(图3)。体内消融或扩增cDC1实验进一步证明,真皮cDC1是触发自身反应性CD8+ T细胞反应所必需的,对小鼠白癜风发生发展至关重要。
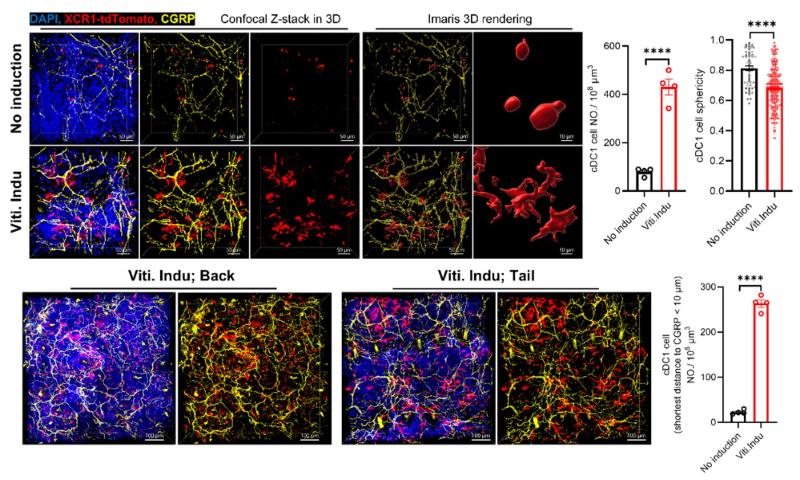
图3 白癜风造模小鼠皮损真皮cDC1处于活化状态且与CGRP+ 感觉神经紧密互作
为了探究CGRP+ 感觉神经对真皮cDC1的调控机制,研究团队构建了cDC1特异性敲除CGRP受体基因小鼠(Xcr1Cre: Calcrlfl/fl,cKO),实验结果表明,cKO小鼠发病显著轻于对照小鼠,说明感觉神经通过CGRP-CALCRL轴调控真皮cDC1细胞功能,进而调控小鼠白癜风疾病发展(图4)。
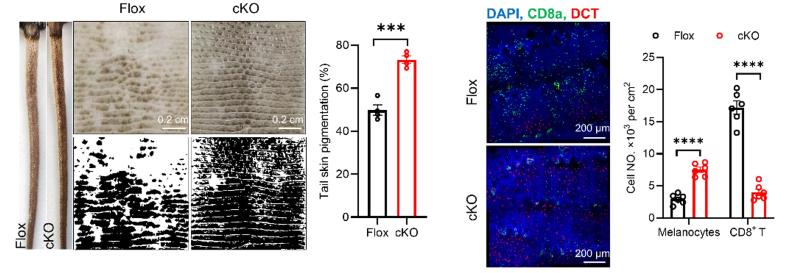
图4 cDC1特异性CGRP受体敲除改善白癜风造模小鼠的疾病表型
研究团队搭建了多种体外共培养体系,探究感觉神经元或CGRP对cDC1功能的影响。结果发现,神经元共培养和CGRP处理,均可以增强cDC1细胞的抗原提呈能力,同时促进CD8+ T细胞产生IFN-γ的能力也显著增强。神经元共培养的cDC1与CGRP处理的cDC1有相似的转录组改变,上调基因可以显著富集到T细胞介导的细胞毒和IFN-γ反应等信号通路。当采用来自cKO小鼠的cDC1细胞时,神经元共培养对cDC1功能的影响被显著削弱,说明感觉神经元主要依赖于CGRP调控cDC1细胞功能。白癜风造模小鼠皮肤进行免疫荧光染色发现, cDC1过度活化且缠绕着CGRP+ 感觉神经,cDC1周围有大量克隆增生的CD8+ T细胞,这些细胞部分迁移到真表皮交界处,那里正是黑素细胞存在的位置。结合体内外实验结果,研究团队创新性揭示了白癜风新的致病机制:感觉神经元-CGRP-cDC1-CD8+ T 细胞轴(图5)。
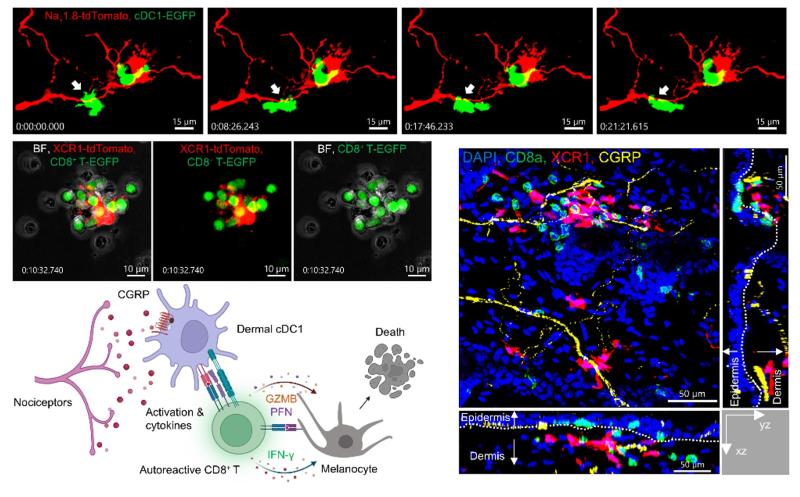
图5 白癜风致病新机制:感觉神经元-CGRP-cDC1-CD8+ T 细胞轴
本课题的出发点是解决白癜风靶向治疗药物奇缺的临床困境,于是研究团队根据神经免疫新机制,探究阻断“感觉神经元-CGRP-cDC1-CD8+ T 细胞” 轴是否可以有效治疗白癜风?在临床上,阻断CGRP信号通路的药物已应用于治疗偏头痛。已上市的包括4种CGRP或其受体的单克隆抗体、4种CGRP受体小分子拮抗剂。考虑到白癜风患者皮肤用药、长期用药的特点,研究团队聚焦于小分子化学物,可用于改造开发外用剂型。2024年,瑞美吉泮口崩片(Rimegepant)获批在中国上市用于治疗偏头痛,成为该研究的首选小分子。
首先,研究团队在白癜风造模小鼠中观察了瑞美吉泮的效果。结果发现,瑞美吉泮和鲁索替尼均能有效改善小鼠疾病表型,二者之间没有差异;但通过流式检测真皮cDC1后发现,瑞美吉泮比鲁索替尼更显著的抑制cDC1细胞扩增,具有一定的潜在优势。接着,研究团队改造出了瑞美吉泮外用软膏剂型,并发起了一项单盲临床试验,57例病人分为三组,干预6~12周。A组仅采用安慰剂或0.1%瑞美吉泮软膏;B组在采用安慰剂或0.1%瑞美吉泮软膏的基础上,每周一次联合NB-UVB光疗;C组在同一个患者身上选两块近邻白斑,分别采用安慰剂或0.1%瑞美吉泮软膏,同时联合光疗。三组结果均表明,瑞美吉泮软膏可以帮助患者皮肤复色,显著提高白斑复色率。综上,联合动物模型和临床试验,研究团队证明:CGRP受体拮抗剂可以有效改善小鼠和人类的白癜风(图6)。
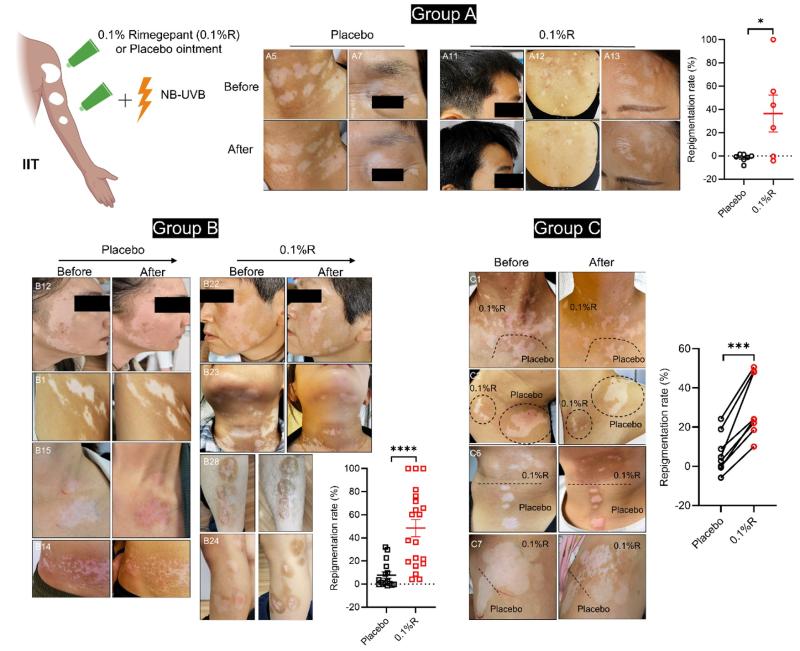
图6 0.1%瑞美吉泮软膏显著改善患者的白癜风表型
总结起来,该研究阐明了白癜风皮损中感觉神经通过分泌CGRP调控真皮cDC1的功能状态,显著增强其抗原提呈能力和共刺激分子表达,从而启动并放大针对黑素细胞的自身免疫性CD8+ T细胞反应,最终导致表皮黑素细胞的进行性破坏和皮肤白斑形成。通过CGRP受体拮抗剂(瑞美吉泮,Rimegepant)阻断这一致病性的CGRP-CALCRL信号轴,能够显著抑制cDC1细胞扩增和杀伤性CD8+ T细胞反应,从而为光疗刺激下的黑素细胞再生和迁移维持一个免疫抑制性的微环境。特别地,该研究从白癜风靶向治疗药物奇缺的临床问题出发,揭示了白癜风“感觉神经元-CGRP-cDC1-CD8+ T细胞”新机制,为白癜风治疗策略研发提供了新的理论依据和靶标。同时,团队改造的0.1%瑞美吉泮软膏,在临床试验中展现出良好的治疗效果,形成了完整的“临床-基础-临床”的研究环路(图7)。
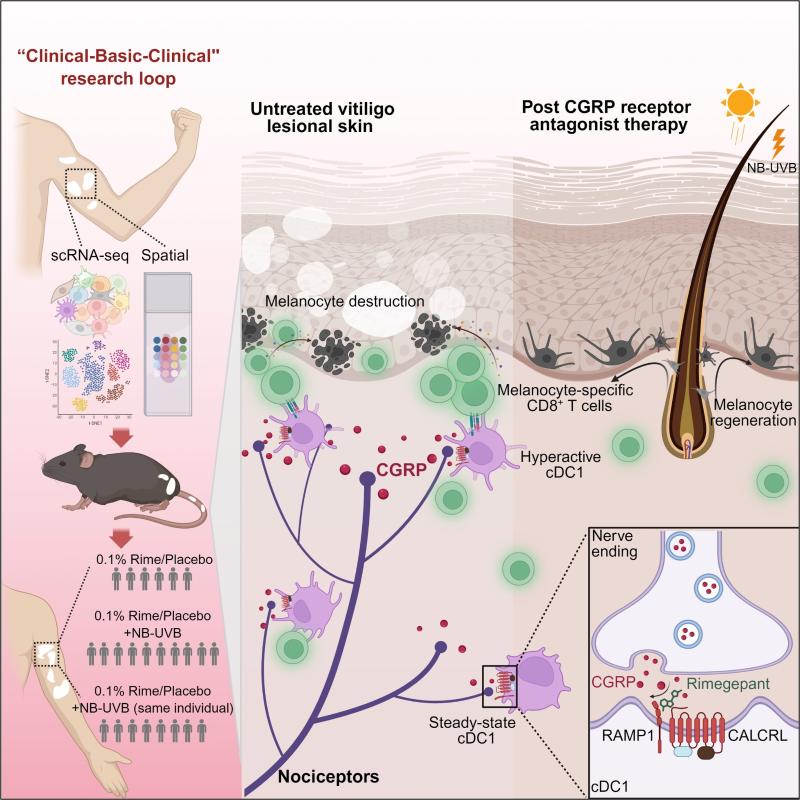
图7 研究机制示意图
本研究受到国家自然科学基金原创探索计划(82450903)、国家自然科学基金联合基金项目(U22A20310)、上海市“科技创新行动计划”实验动物研究项目(22140903100)、国家自然科学基金(82373470,82203914,82173417)和上海市科技创新行动计划(22QA1407600,23ZR1480700)的支持。上海交通大学医学院王宏林教授的博士研究生杨秀莉和丁文翔为文章的共同第一作者。
论文链接:https://www.cell.com/immunity/abstract/S1074-7613(25)00239-0
引用文献:
1. Tavoletti, G., Avallone, G., Conforti, C., Roccuzzo, G., Maronese, C.A., Mattioli, M.A., Quaglino, P., Zalaudek, I., Marzano, A.V., Ribero, S., and Alberti-Violetti, S. (2023). Topical ruxolitinib: A new treatment for vitiligo. J Eur Acad Dermatol Venereol 37, 2222-2230. 10.1111/jdv.19162.
2. Lumpkin, E.A., and Caterina, M.J. (2007). Mechanisms of sensory transduction in the skin. Nature 445, 858-865. 10.1038/nature05662.
3. Riol-Blanco, L., Ordovas-Montanes, J., Perro, M., Naval, E., Thiriot, A., Alvarez, D., Paust, S., Wood, J.N., and von Andrian, U.H. (2014). Nociceptive sensory neurons drive interleukin-23-mediated psoriasiform skin inflammation. Nature 510, 157-161. 10.1038/nature13199.
4. Kashem, S.W., Riedl, M.S., Yao, C., Honda, C.N., Vulchanova, L., and Kaplan, D.H. (2015). Nociceptive Sensory Fibers Drive Interleukin-23 Production from CD301b+ Dermal Dendritic Cells and Drive Protective Cutaneous Immunity. Immunity 43, 515-526. 10.1016/j.immuni.2015.08.016.
5. Klein Wolterink, R.G.J., Wu, G.S., Chiu, I.M., and Veiga-Fernandes, H. (2022). Neuroimmune Interactions in Peripheral Organs. Annu Rev Neurosci 45, 339-360. 10.1146/annurev-neuro-111020-105359.
6. Yin, Q., Sun, L., Cai, X., Lou, F., Sun, Y., Wang, B., Jiang, B., Bao, L., Li, X., Song, N., et al. (2022). Lidocaine Ameliorates Psoriasis by Obstructing Pathogenic CGRP Signaling‒Mediated Sensory Neuron‒Dendritic Cell Communication. J Invest Dermatol 142, 2173-2183 e2176. 10.1016/j.jid.2022.01.002.
7. Cai, X., Han, M., Lou, F., Sun, Y., Yin, Q., Sun, L., Wang, Z., Li, X., Zhou, H., Xu, Z., et al. (2023). Tenascin C+ papillary fibroblasts facilitate neuro-immune interaction in a mouse model of psoriasis. Nature Communications 14. 10.1038/s41467-023-37798-x.