
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大李丹与合作者受邀总结α-syn相分离/相变在突触功能与神经退行性疾病中的作用
α-突触核蛋白(α-Syn)是一种在神经末梢突触前体中高度表达的内在无序蛋白,广泛参与突触小泡的动态调控。同时,其病理性相变聚集体是帕金森病等多种神经退行性疾病(总称为突触核蛋白病)的核心病理标志物,并与疾病的发生与进展密切相关。上海交通大学Bio-X研究院的李丹课题组长期聚焦于α-syn相变聚集的分子机制研究,发现α-syn病理性聚集的结构多态性,并系统阐释其通过多种膜受体介导的病理性脑内扩散及引发神经炎症反应的病理机制。近期李丹与合作者发现,α-Syn能够通过液-液相分离(LLPS)动态调控突触小泡。其系统性工作揭示了α-syn相分离相变的多样性及其在突触稳态与病理形成中的多重复杂作用。
基于在本领域长期的系统性研究成果,李丹教授近期特受邀与美国辛辛那提医学院刁佳杰教授在Trends in Cell Biology杂志上发表题为“α-Synuclein condensation in synaptic vesicle function and synucleinopathies”的综述文章。该综述系统梳理了α-syn通过LLPS动态调控突触小泡功能的分子机制,总结了α-syn异常相变聚集与突触核蛋白病发生发展的关系,并探讨了突触核蛋白病中突触小泡的功能损伤及其在疾病进程中的关键作用。

综述首先介绍了α-syn发生LLPS的分子基础及α-syn与突触小泡相互作用的机制。随后总结了α-syn在调控突触小泡功能中的作用,包括调控突触小泡的聚集(clustering)、突触小泡的膜融合(fusion)及神经递质释放(neurotransmitter release)。
进一步,综述系统论述了α-syn相分离失衡与突触核蛋白病之间的联系(图1)。当α-syn的相变调控异常,其液态凝聚体可转化为固态病理性淀粉样纤维。这一转变具有双重致病作用:一方面,α-syn功能性耗竭会破坏其对突触小泡的正常调控,导致突触小泡池稳态紊乱和神经递质释放障碍;另一方面,形成的淀粉样纤维不仅可以直接破坏膜结构,还能通过细胞间传播扩大病理范围,并诱发神经炎症反应,最终造成突触结构和功能的持续性退化(图1)。最后,综述总结了多种靶向α-syn LLPS及α-syn与突触小泡相互作用的潜在干预策略(图1)。
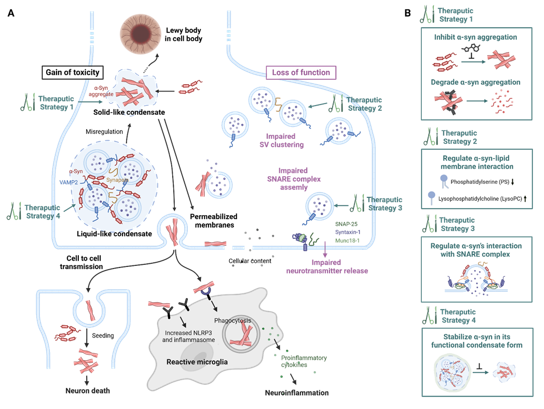
图1. α-Syn液-液相分离失衡在病理聚集形成中的作用及其毒性机制与干预可能性
本综述强调了α-syn相分离在突触功能调控与神经退行性病理进程中的关键作用,对理解突触核蛋白病的发病机制及发展新颖的疾病干预手段提供了新的思路和方向。该工作获得了国家自然科学基金委员会的资助。
论文链接:https://pubmed.ncbi.nlm.nih.gov/40307115/