
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大代彬团队揭示β-乳球蛋白纤维的组装机制,为功能性纳米材料开发提供新思路
近日,电子信息与电气工程学院感知科学与工程学院代彬副教授团队在β-乳球蛋白(β-LG)纤维的组装机制及其多态性研究方面取得了重要进展。团队利用冷冻电子显微镜技术,揭示了β-LG纤维的保守核心结构及多种聚集形态,为β-乳球蛋白基功能材料的精准调控提供了新的理论依据。研究成果以“β-Lactoglobulin Forms a Conserved Fibril Core That Assembles into Diverse Fibril Polymorphs”(β-乳球蛋白形成保守纤维核心并组装成多样化的纤维多态结构)为题,发表在国际著名期刊《Nano Letters》上。

研究背景
在自然界,蛋白质可以通过自组装形成纳米尺度的纤维状结构,并被广泛应用于食品、生物医药和材料科学领域。β-乳球蛋白(β-LG)是乳清蛋白的主要成分之一,在酸性环境(pH 2)和高温(90°C)条件下能够自组装形成纤维。这些纤维不仅影响食品的流变特性,还因其高度稳定、可调控的纳米结构,在药物递送、生物传感、智能材料等领域展现出广阔的应用前景。尽管β-LG纤维的形成过程已被广泛研究,但其分子级别的组装机制及不同构型的形成规律仍未完全解明。这一知识空白限制了β-LG在功能性材料中的理性设计和优化。代彬团队的研究通过高分辨率Cryo-EM解析了β-LG纤维的核心结构,揭示了其多态性组装机制,为基于β-LG纤维的纳米材料设计提供了新的理论基础。
创新成果
研究团队利用冷冻电镜技术解析了β-LG纤维的高分辨率结构,发现其核心由两根包含1-32位氨基酸序列的原纤维组成。进一步研究表明,单原纤维可通过不同的界面相互作用组装成四种不同的纤维多态性(图1)。研究发现核心结构的稳定性主要由疏水相互作用维持,例如Leu10、Ile12、Val15、Trp19和 Leu22等关键残基通过相互作用形成稳定的U形折叠结构,确保纤维核心的稳定性。
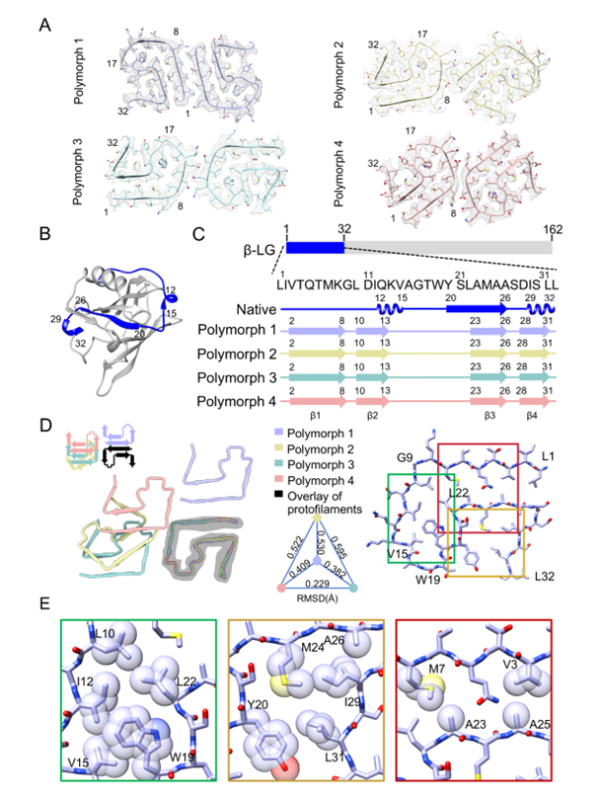
图1 β-乳球蛋白淀粉样纤维的多态性结构和原纤维分子内相互作用
不同的界面相互作用(亲水相互作用、氢键、静电作用)决定了四种β-LG纤维多态性的形成(图2)。这些结构特征赋予β-LG纤维高度可控的机械性能和化学稳定性,为蛋白质基功能材料提供了丰富的结构多样性。
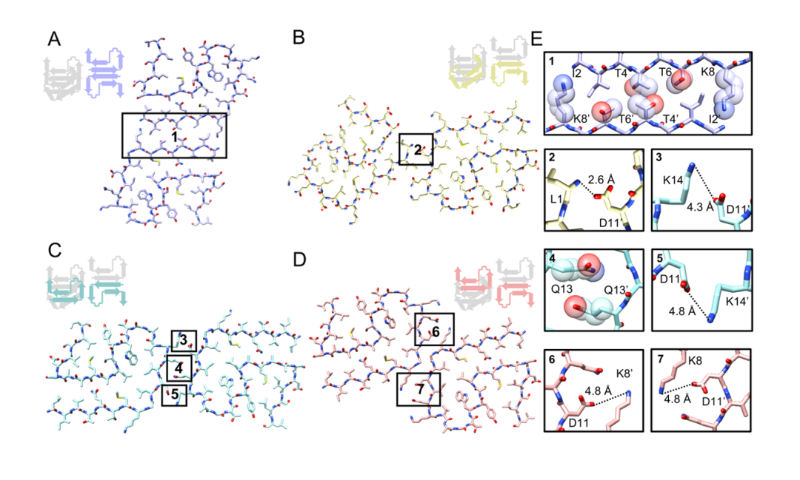
图2 β-乳球蛋白纤维多态性界面的相互作用
这一研究不仅深入解析了β-LG纤维的分子组装机制,还为基于β-LG纤维的食品增稠剂、生物传感器、功能涂层、药物递送系统的开发提供了新的设计思路。
研究团队
海交通大学电院感知学院博士生许勇宜和李丹妮为本研究共同第一作者,上海交通大学电院感知学院代彬副教授为通讯作者,中科院生物与化学交叉研究中心刘聪研究员、上海交通大学李丹教授及本文其他作者对研究也作出了重要贡献。上海交通大学为第一单位,该工作得到了国家自然科学基金、上海市科学技术委员会等基金的支持。
论文链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.5c00137