
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大药学院团队发表关于氨肽酶N响应的炎症特异性硫化氢供体研究成果
鉴于传统抗炎药物在临床应用中暴露的诸多问题,开发具有新机制的抗炎药物已成为优化现有抗炎疗法的重要方向。近日,上海交通大学药学院王寅副教授课题组联合袁运生副教授、赵亚雪副教授等合作者在《德国应用化学》报道了一种氨肽酶N响应的炎症特异性硫化氢供体用于伤口的修复。该文章入选《德国应用化学》的热点文章(Hot Paper)。
氨肽酶N(APN)是一种锌基金属蛋白酶,在多种免疫细胞中过度表达,在炎症反应的发生发展过程中发挥着重要作用。APN作为酶的主要功能是将以丙氨酸为代表的氨基酸从肽的N端切割下来,以介导特定的生物学过程。利用APN这一特性,构建了一种APN激活的自分解型COS/H2S供体(AlaCOS),以实现炎症特异性的H2S递送。该分子包含一个丙氨酸保护基,一个对氨基苄基连接子,以及一个基于硫代碳酸苯酯的COS释放基元。在APN存在的条件下,该分子能够脱除丙氨酸保护基,激活1,6-消除反应,释放一分子COS,后者在广泛存在的碳酸酐酶催化下转化为H2S(图1A)。除被APN激活缓释H2S(图1B)外,AlaCOS不受生理环境中的其他酶(如胰蛋白酶、酯酶)、金属离子、氨基酸、还原剂、活性氧(ROS)等物质的影响(图1C),展现出APN特异性激活特性。由于H2S的抗氧化特性,AlaCOS经由APN激活后清除DPPH自由基的能力显著增强。另外,AlaCOS还能够显著降低经脂多糖(LPS)刺激后小鼠巨噬细胞RAW264.7内的ROS水平。
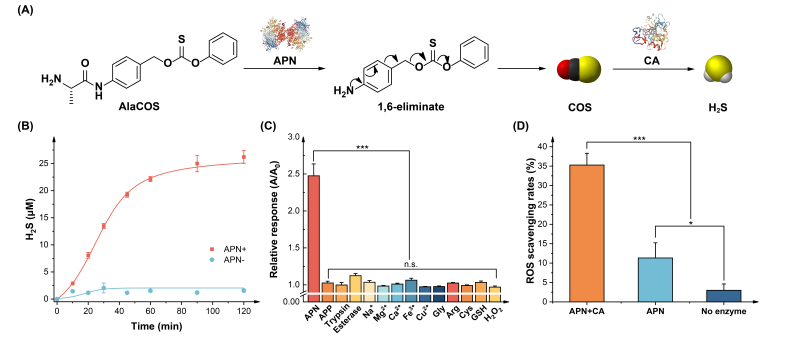
图1. (A)AlaCOS酶促控释H2S的分子机制;(B)APN激活的H2S释放曲线;(C)AlaCOS的APN特异性验证结果;(D)AlaCOS的DPPH自由基清除能力
随后,作者开展了一系列体外实验评估AlaCOS的抗炎能力(图2),结果表明AlaCOS能够抑制NF-κB通路,下调一系列促炎性细胞因子的表达,促进巨噬细胞从促炎性M1表型向抗炎性M2表型极化。值得注意的是,AlaCOS的抗炎效果显著强于不具备控释能力的H2S供体Na2S,证明了APN激活的可控递送策略对提升H2S的抗炎效果具有重要意义。详尽的RNA测序分析也进一步揭示了AlaCOS对炎症反应过程的影响。进一步地,作者使用小鼠全层皮肤损伤模型研究了AlaCOS的体内抗炎能力。与未处理组和Na2S处理组相比,AlaCOS显著加速了伤口愈合过程,这归因于AlaCOS的炎症反应调控作用,使巨噬细胞向抗炎性M2表型极化,而后者在伤口愈合中发挥着关键作用。
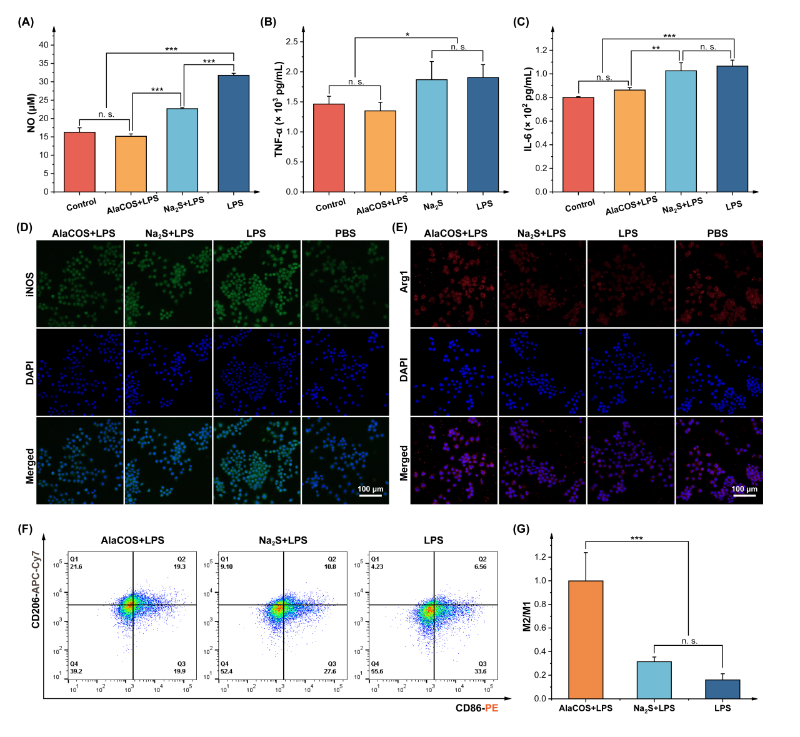
图2. AlaCOS的体外抗炎能力评估。与AlaCOS共孵育后RAW264.7细胞外(A)一氧化氮(NO);(B)肿瘤坏死因子-α(TNF-α)及(C)白介素-6(IL-6)水平;AlaCOS处理后RAW264.7细胞内(D)诱导型一氧化氮合酶(iNOS)和(E)精氨酸酶1(Arg1)的免疫荧光染色(F, G)流式细胞术分析巨噬细胞极化作用
为实现H2S递送的精准监测,作者随后将香豆素荧光团引入供体结构中制备了自报告荧光COS/H2S供体(AlaBTCCou)。经APN激活后,AlaBTCCou不仅能经过1,6-消除过程释放COS,同时伴随7-羟基香豆素分子的释放及自报告荧光的产生(图3),成功实现了细胞及动物水平上的H2S递送监测。这一策略不仅实现了H2S递送的可视化,同时也提供了构建H2S/活性分子共递送体系的通用方法和平台。
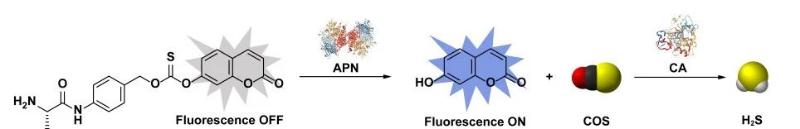
图3. AlaCOS酶促控释H2S的表达及自报告荧光产生的分子机制
结论:综上所述,本工作报道了一种APN激活的自分解型COS/H2S供体,可实现炎症特异性H2S递送,展现出显著的体外抗炎作用,通过重编程巨噬细胞极化有效促进了伤口愈合(图4)。通过引入荧光团构建了自报告荧光COS/H2S供体,进一步实现了H2S递送的可视化。
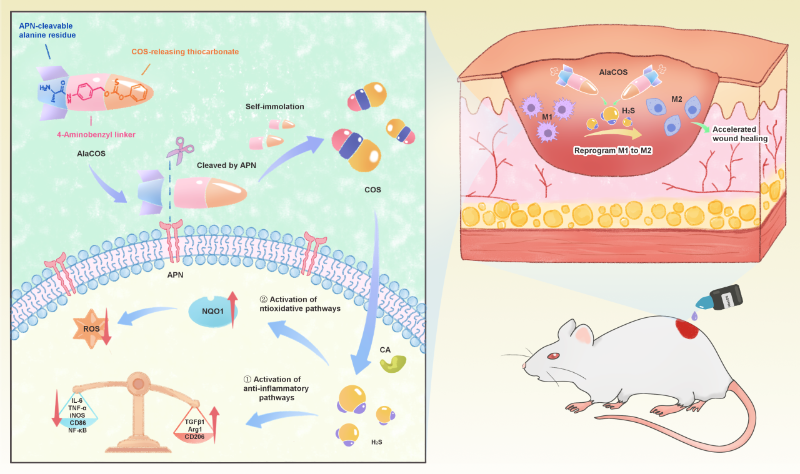
图4. AlaCOS发挥生理作用的机制示意图
文章的第一作者是上海交通大学药学院博士研究生荣帆和硕士研究生包汶鑫、李冠毅。
论文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202423527