
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大张延教授和达林泰研究员联合发文:系统揭示糖基转移酶GalNAc-T家族对黏蛋白MUC1的O-GalNAc糖基化调控规律
黏蛋白Mucin1(MUC1)是一种广泛分布于人体上皮细胞的高丰度O-GalNAc糖蛋白。MUC1在乳腺癌,肺癌,结肠癌等常见癌症中高度表达,其多位点高重复的O-GalNAc糖基化异常已被广泛认为是癌症免疫治疗的重要靶点。因此针对MUC1的肿瘤疫苗开发一直是国际研究热点,然而MUC1的肿瘤疫苗研究仍普遍存在免疫原性低和有效性差的瓶颈问题。O-GalNAc糖基化位点和糖链结构的多样性对蛋白免疫学效应至关重要,人体内蛋白质的O-GalNAc糖基化修饰过程是由20种不同的GalNAc-Ts调控起始合成的。理解和揭示20种人类GalNAc-Ts如何协同调控MUC1糖基化的位点特异性和O-糖基化的过程与机制,对未来合理设计和科学开发糖蛋白疫苗具有重要意义。
上海交通大学张延教授团队联合达林泰团队和石婷团队,从MUC1初始糖基化的修饰规律着手,系统性地揭示了O-GalNAc糖基化起始酶GalNAc-Ts对黏蛋白MUC1的糖基化调控规律,为科学理解MUC1疫苗开发中因糖基化位点占有差异引起的免疫学效应差异提供了基础理论依据。该研究成果近日在国际知名期刊《ACS catalysis》在线发表:“Comprehensive Investigations of MUC1 O-glycosylation Process Reveal Initial Site Preference by the Polypeptide GalNAc Transferases”。

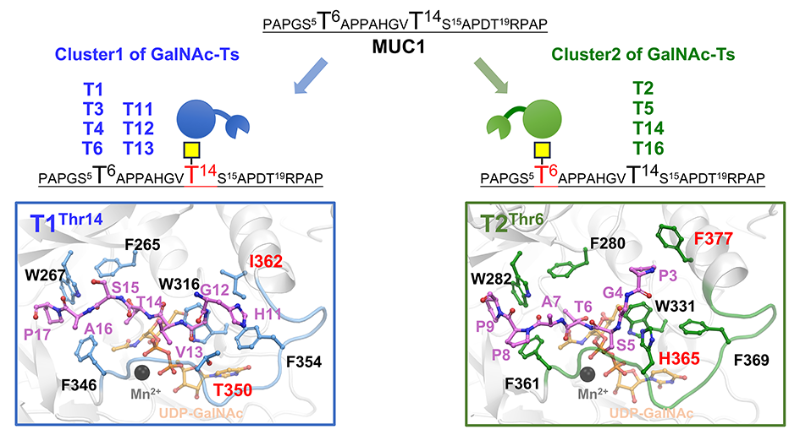
首先,研究团队成功解决了人源O-GalNAc糖基化起始酶的获得性问题,利用自主知识产权的原核表达体系表达了14种具有高催化活性的GalNAc-Ts,解决了以往利用真核表达系统生产GalNAc-Ts的高成本、低收率的问题。在此基础上,利用体外酶活和高分辨质谱检测,全面系统地研究了这些GalNAc-Ts对MUC1衍生肽的位点特异性糖基化偏好和反应规律。该研究发现GalNAc-Ts酶家族可分为两大类具有不同起始糖基化位点催化选择性,初始选择性影响后续糖基化过程和位点占有率规律。并通过分子动力学模拟和定点突变分析揭示了初始位点选择性的酶分子机制,发现GalNAc-Ts的初始O-糖基化位点选择性受其肽结合口袋中的两个关键氨基酸残基控制。量子力学计算进一步详细描绘了两类酶的催化反应机制。
该项研究不仅解决了糖基转移酶GalNAc-Ts的获得性问题,同时基于体外酶活检测、高分辨质谱解析、分子动力学模拟、点突变分析和量子力学计算等系统性解析了O-GalNAc起始糖基转移酶对底物MUC1的选择机制程序性糖基化规律,这种由糖基转移酶对底物不同位点的特异性偏好,最终调控了生理状态下MUC1上不同位点的糖基化占有率的不同,为理解MUC1疫苗开发中因糖基化位点占有差异引起的免疫学效应差异提供了理论基础。同时,该研究也为后续可控合成其他O-GalNAc糖蛋白提供酶学工具以及理论基础。
上海交通大学系统生物医学研究院张延教授和达林泰副教授为该论文的共同通讯作者,博士生张涵和硕士生宋开元为该论文的第一作者。该研究得到上海交通大学生命科学技术学院石婷研究员、中国科学院上海有机所林亮研究员以及南开大学生科院鲁聪聪副教授的支持。同时,该工作得到了上海交通大学基础研究特区计划以及国家自然科学基金项目的资助。
论文链接:https://pubs.acs.org/doi/10.1021/acscatal.4c05719