
 探索发现 · 交大智慧
探索发现 · 交大智慧
Science发表附属第九人民医院曹禹团队合作研究成果,揭示人类细胞磷酸稳态平衡的调节机制
“生不孤,必有磷”。磷是构成生命的五种基本元素之一,和碳、氧、氢、氮一样重要。生命体内的有机磷主要以核酸、磷脂以及能量分子的形式存在,而无机磷的主要存在形式包括构成骨骼主要部分的羟基磷灰石、游离磷酸根或焦磷酸。在这些存在形式中,游离磷酸根是磷元素最为主要的流通形式。生命体对于磷酸可以说是“爱恨交织”:一方面,磷酸作为结构分子、能量分子、信号分子的组成部分,必须维持一定水平以利于被生物利用;另一方面,过高的磷酸根浓度不仅对正常的生化反应造成了干扰,还因其易与钙、铁等多价态金属离子形成沉淀的原因威胁着人体的健康,导致多种疾病,例如原发性基底节脑钙化(Primary Basal Ganglion Calcification)或者血栓。在原发性基底节脑钙化患者中,无法排放的磷酸根在神经组织中积累,并与钙离子形成钙盐沉淀,从而导致退行性病变。在凝血过程中,由于多聚磷酸具有激活凝血酶与凝血因子的能力,磷酸的过量积累可引起血栓等血液问题。因此,保持细胞磷酸库存的稳定,并在需要时候及时“开闸泄磷”是事关生命健康的核心需求之一。

为维持细胞内磷酸水平的稳定,生命在进化过程中形成了多种细胞膜上的转运蛋白来负责磷酸的摄取和排放。在高等生物特别是人类中,尽管已经发现了多种负责磷酸内向运输的转运体蛋白,但是具备向外排放磷酸能力的分子系统目前仅仅发现一种,即XPR1蛋白。人类XPR1蛋白由SLC53A1基因所编码,已有的遗传学和生化研究表明,该蛋白主要负责在细胞内磷酸过载的情况下向外释放磷酸,这一释放过程受到焦磷酸肌醇的调控。焦磷酸肌醇分子在细胞内磷酸水平异常升高时后大量产生,被视作为磷酸稳态失衡的信号分子。XPR1功能受损的情况下将导致细胞内磷酸的积累,从而影响细胞功能(例如引发破骨细胞功能受损)并引起磷酸盐的析出积累,最终导致多组织器官出现钙化。有证据表明XPR1突变造成的磷酸外排受损将引起星形胶质细胞向血液释放磷酸能力不足,从而导致脑脊液中磷酸异常积累,最终产生磷酸钙沉淀而引发病变。
XPR1在细胞中维持磷稳态平衡的作用使之成为磷酸代谢研究与钙化疾病探索的目标。然而,其结构信息的缺乏使得人们难以理解其行使功能的分子细节,特别是其如何受到焦磷酸肌醇的激活而进行磷酸外排的调控机制。
曹禹团队新发表论文的研究结果显示,XPR1是由负责磷酸运输的磷酸通道部分和负责焦磷酸肌醇识别的信号感受器部分构成的生物大分子机器:十跨膜螺旋构成的跨膜结构域(TMD)包围形成了一个可供磷酸分子穿越细胞膜的孔道,这一孔道受到色氨酸573的禁控,随着色氨酸573的旋转移位而开放或关闭;细胞内的可溶区SPX结构域则形成了焦磷酸肌醇感受器结构,用于结合焦磷酸肌醇并控制TMD的构象变化。然而,出乎意料的是,该研究论文发现XPR1同时存在两个焦磷酸肌醇结合位点:第一结合位点位于SPX感受器之间,这一位点可以结合焦磷酸肌醇或磷酸肌醇,并通过结合焦磷酸肌醇或磷酸肌醇发生SPX之间的二聚化,稳定TMD的构象使之易于开放;第二结合位点则位于SPX与TMD之间,这一位点的特点是空间较大,两侧相距较远的正电荷基团使之难于捕获较小的磷酸肌醇分子,只有因为焦磷酸化而尺度较大的焦磷酸肌醇才能适配这一“空旷”口袋并与之结合。这一对焦磷酸具有偏好性的第二位点的发现,解决了此前科学家的疑惑,即与磷酸肌醇相比,XPR1为何对于焦磷酸肌醇更为敏感,更容易被激活。
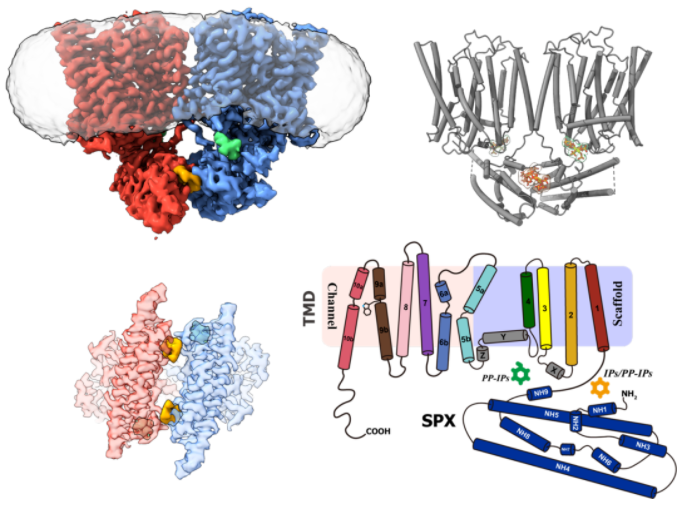
图1:人类XPR1的冷冻电镜密度图和分子模型
除解析了XPR1识别焦磷酸的结构基础之外,本研究还通过电生理的方法,首次表明XPR1实际上是作为磷酸通道发挥生物学作用,并非此前认定的转运体蛋白。结合结构生物学与功能生物学的研究结果,本论文提出XPR1是一个焦磷酸肌醇门控的磷酸通道,是细胞用于感知磷酸代谢信号并做出磷酸外排应答的双功能分子机器。这一研究为人们理解磷酸代谢与磷酸稳态维持的细胞生物学机制提供了结构基础,并为探索相关钙化疾病的分子病理提供的指导与见解。
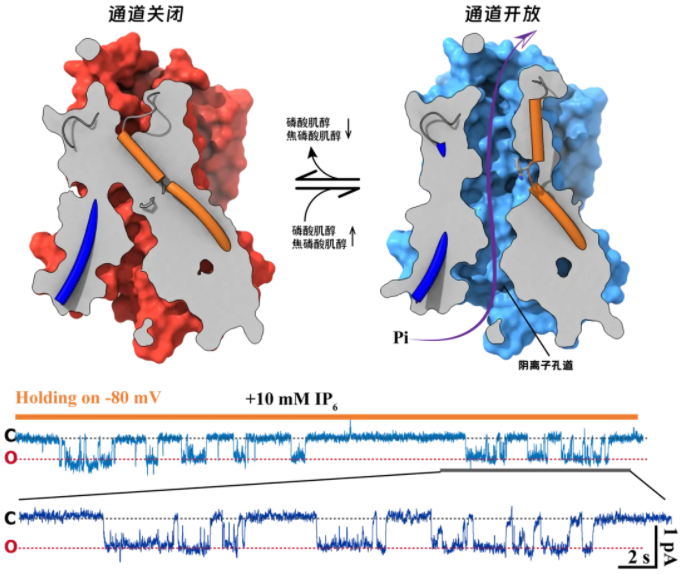
图2:XPR1通道的开放与关闭
上海交通大学医学院附属第九人民医院精准医学研究院与骨科的曹禹研究员与中国药科大学的于烨为该论文的共同通讯作者。上海精准医学研究院的博士生鲁毅、中国药科大学的博士生岳晨茜、美国西南医学中心的张丽博士以及上海交通大学医学院附属仁济医院的姚德强副研究员为该论文的共同第一作者。本研究中的冷冻电镜数据的采集与加工分析均在上海精准医学研究院电镜中心进行。功能实验主要在上海精准医学研究院生物成像平台、蛋白质平台与组学平台完成。本论文研究的完成获得了国家自然科学基金、上海市教委“IV类高峰”项目与上海高水平地方高校创新团队的支持。