
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大张雷研究组揭示微丝结合蛋白Drebrin调控肝癌发生发展的新功能和分子机制
近日,国际学术期刊Hepatology在线发表了上海交通大学生命科学技术学院张雷/金蕴韵团队的最新研究成果“The actin-binding protein drebrin disrupts NF2-LATS kinases complex assembly to facilitate liver tumorigenesis”。该研究揭示了DBN1(Drebrin)通过参与Hippo信号通路调控肝癌发生发展的新功能和分子机制,为肝癌的治疗提供了新的策略。生命科学技术学院博士后孙洋为第一作者,特聘教授张雷、副研究员金蕴韵为共同通讯作者。
肝癌(Hepatocellular carcinoma,HCC)是世界范围内少数具有高发病率、高死亡率和不良预后的肿瘤之一。Hippo信号通路在进化上高度保守,参与调控器官大小和肿瘤发生。Hippo信号通路主要通过抑制YAP的致癌活性限制细胞生长和肿瘤发生,Hippo信号通路的失调会诱发肝癌。目前靶向YAP的肝癌预防和治疗方法仍然有限。DBN1是一个细胞骨架相关蛋白,在肿瘤特别是肝癌中的作用和调节机制尚未明晰,DBN1与Hippo信号通路之间的联系也未被揭示。因此,深入解析DBN1如何参与并调控Hippo信号通路,对于探索疾病进程的调控机制和开发肝癌的耐药性治疗方案具有重要意义。
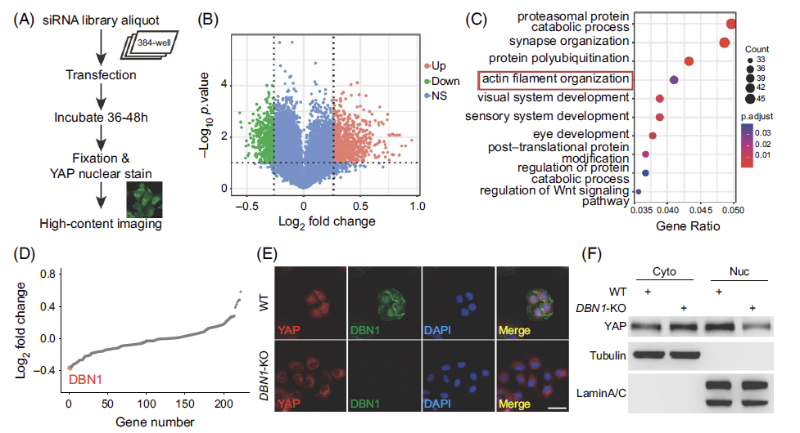
图 1:全基因筛选鉴定YAP调控因子
团队通过全基因组siRNA筛选聚类分析后发现,细胞骨架相关蛋白DBN1(Drebrin)敲低后YAP在细胞中的核质分布发生明显改变。随后团队构建了DBN1敲除细胞,经敲除细胞的染色和核质分离验证,DBN1敲除后YAP显著出核,DBN1是YAP的一个新的调控因子。
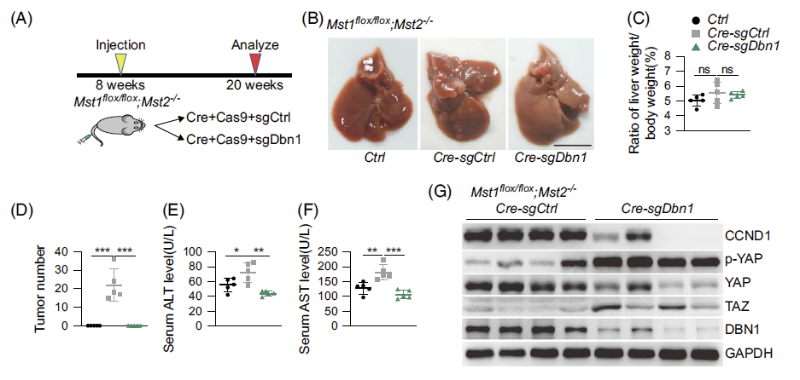
图 2:DBN1敲除抑制YAP高激活肝癌的进展
YAP的高度激活对于肝癌的发生发展具有极其重要的促进作用。为了验证DBN1在肝癌中的功能,团队使用了肝脏特异敲除MST1/2并高激活YAP的小鼠。通过高压尾静脉注射和睡美人(Sleeping Beauty, SB)转座子系统在肝脏中特异性敲除DBN1后,YAP高激活诱导的肝癌进程被显著抑制,肝脏功能改善明显,YAP的活性被抑制,下游靶基因的表达减弱。
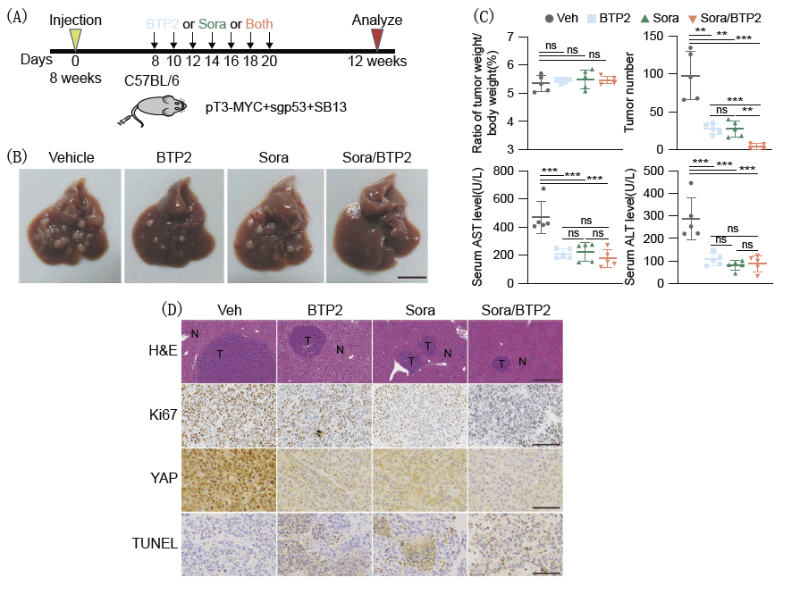
图 3:BTP2处理拮抗索拉非尼耐药
在使用DBN1小分子抑制剂BTP2处理细胞后发现,BTP2能够通过抑制DBN1的功能,进而抑制YAP入核。YAP的激活在临床上与肝癌病人的索拉非尼耐药密切相关,因此团队探究了通过抑制DBN1来拮抗索拉非尼耐药的可能。小鼠实验结果表明,BTP2处理抑制了肝癌的进展,当其和索拉非尼联合给药后肝癌被显著抑制。该研究为肝癌的临床治疗提供了新思路。
该项研究得到上海交通大学生命科学技术学院的大力支持。同时该研究还得到国家自然科学基金委、国家科技部和上海市科委的经费资助。
论文链接:https://journals.lww.com/hep/abstract/9900/the_actin_binding_protein_drebrin_disrupts.1039.aspx