
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大蒋恒团队联合浙江理工大学沈程硕团队发表氢原子转移催化的自由基芳基迁移新策略
苄胺类分子片段广泛存在于可治疗人类重大疾病的市售药物分子中,例如治疗阿尔茨海默症药物卡巴拉汀(Rivastigmine)以及治疗心脑血管疾病药物依泽替米贝(Ezetimibe)等等。因此,通过简单易得的原料来实现复杂苄胺衍生物的高效合成对于新药发现具有重要应用价值(图1a)。与Gabriel合成和还原氨化等常用方法相比,胺的N-α位C(sp3)–H键直接芳基化是一种构建苄胺的高效策略,可以避免繁琐的底物制备步骤,极大简化合成路线。该策略亟待解决的难点在于:对于具有多种N-α位C(sp3)-H键的二烷基胺和三烷基胺,如何突破位阻效应的局限,对位阻较大的C-H键“精准识别”,选择性地将大位阻烷基的C-H键转化为C-芳基片段,而位阻小的C-H键(例如甲基)则不发生转化(图1b)。
基于此,上海交通大学蒋恒课题组与浙江理工大学沈程硕课题组合作,通过氢原子转移(HAT)催化的1,4自由基芳基迁移新策略成功实现了二级胺衍生物N-α位C(sp3)–H键位点选择性芳基化反应(图1c)。该C–H芳基化转化表现出独特的位点选择性,可精准识别位阻较大的N-α位2º或3º碳的C(sp3)–H键,且底物中N-甲基(1º碳)或位阻较小的2º碳上的C-H键不发生转化(图1d)。反应所使用的脲类底物可通过二烷基胺为原料快速获得,且产物中苄胺的保护基可快速脱除,得到苄位含多种取代基的苄胺类化合物。该方法为复杂苄胺类药物砌块的多样化构建及相关药物化学研究提供了一种有效工具。此外,以脲为底物的N→C芳基迁移,即Clayden重排反应,通常为碳负离子参与的SEAr型迁移。而本文所报道的基于自由基-极性交叉的芳基迁移策略突破了Clayden重排反应模式的局限,使惰性N-α位C(sp3)–H键也可参与转化,且无需释放SO2等气体碎片来促进自由基芳构化过程,为自由基Truce-Smiles重排提供了一种新的反应模式。该成果近期发表于Nature Communications(Nat. Commun. 2024, 15, 6791),上海交通大学药学院蒋恒副教授和浙江大学沈程硕副教授(理论计算)为论文共同通讯作者。上海交通大学药学院博士研究生许婕为论文第一作者。
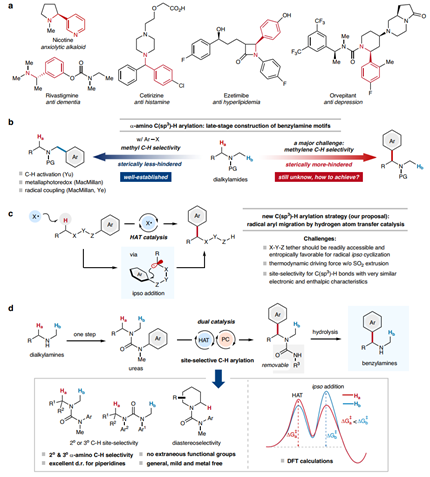
图1. 位点选择性α-氨基C(sp3)–H芳基化构建苄胺
该反应对于多种二烷基胺衍生的脲类底物均展现出优异的位点选择性。此外,苯基、烯烃、醚、酰胺、氰基、酯、噻吩和吡啶等多种官能团或结构单元都对该反应具有良好的耐受性。值得注意的是,该反应的位点选择性不受迁移芳基的电子性质和位阻的影响。在同时存在3o和1o的C–H键时,大多也观察到3o的C–H键芳基化产物(图2)。对于含氮杂环类底物,反应也能够顺利进行,且反应效率不受环系大小的影响。2-或4-取代的哌啶也可以进行该芳基迁移反应,得到具有高非对映选择性的C–H芳基化产物。含有不同取代基和电性的芳基均表现出较高的迁移效率。此外,甲氨甲酰基作为C–H芳基化产物的氨基保护基团可以很容易地通过水解去除(图4a)。
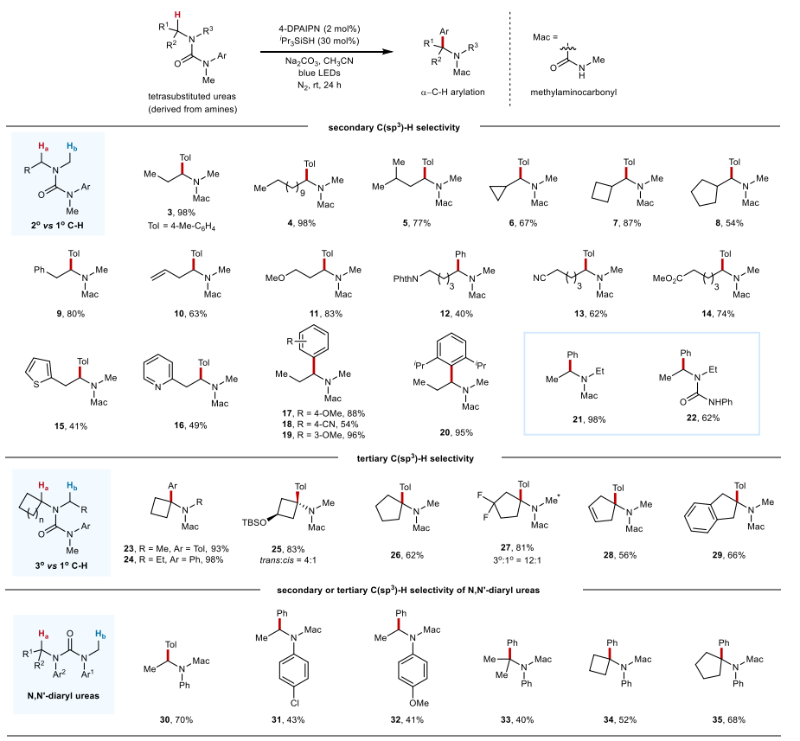
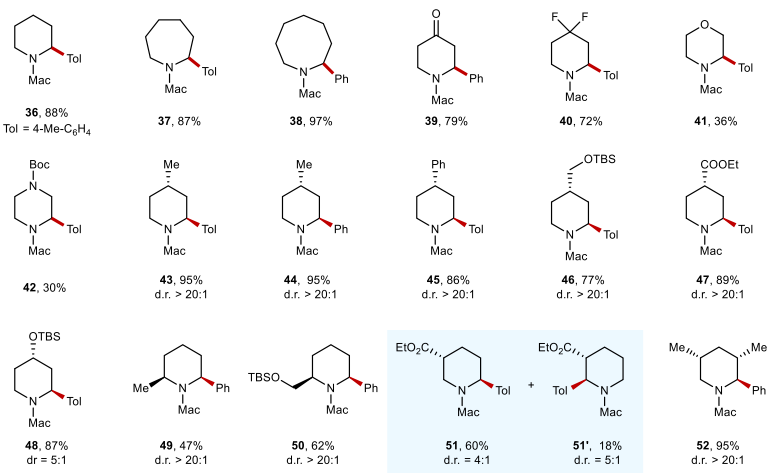
图2. 底物普适性考察
接下来,作者将该C-H芳基化策略成功应用于复杂二级胺类药物分子的C-H键选择性修饰中(图3)。几种含有N-甲基的二级胺类药物分子,如氟西汀(Fluoxetine)、马普替林(Maprotiline)、阿托西汀(Atomoxetine)和去甲替林(Nortriptyline)都可以发生亚甲基C-H键的选择性芳基化,而位阻较小的N-甲基C-H键不参与反应。而在过去的报道中,这类药物分子的N-α位C-H官能团化通常发生在位阻较小的甲基上。因此,该独特的药物分子位点选择性修饰方法可以快速在药物分子中引入过去难以获得的苄胺片段,证明了该自由基芳基迁移新策略在药物化学中的应用价值。对于含有环胺骨架的生物活性分子,如利培酮(Risperidone)的核心哌啶骨架和金雀花碱(Cytisine),也可以顺利发生C-H芳基化反应,且产物具有较高的非对映立体选择性。

图3. 二级胺类药物分子的位点选择性C-H芳基化
接着,作者对反应机理进行了研究:三异丙基硅烷硫醇和模板底物1对4-DPAIPN的Stern-Volmer猝灭实验表明,激发态光催化剂倾向于优先被硫醇猝灭(图4b)。TEMPO可抑制反应发生,表明该反应经过自由基转化过程。该催化体系的量子产率为0.54,表明该反应倾向于进行自由基-极性交叉机制,而不是自由基链反应。此外,在自由基时钟实验中使用2-苯基环丙基胺衍生的脲86,没有检测到开环产物,这表明在反应过程可能不会产生氨基自由基。动力学同位素效应(KIE)研究显示kH/kD = 3.1(图4d),表明HAT过程是一个速率决定步骤。此外,参与芳基迁移的N-α位碳自由基还原电位小于-2.0 V,不能够被低价态光敏剂还原至碳负离子,因此该反应是一个自由基参与的芳基迁移而非传统的阴离子Clayden重排。碳负离子捕获实验也没有观察到相应产物,进一步证明了自由基芳基迁移机制的合理性(更多机理实验请参考论文支撑材料)。
浙江理工大学沈程硕团队对该反应的位点选择性成因进行DFT密度泛函计算,得到的反应能量分布如图所示(图4):与亚甲基C–H芳基化途径相比,初始三异丙基硅基硫自由基对甲基C–H键的HAT过程显示出更低的活化能(15.8 kcal•mol-1 vs. 16.9 kcal•mol-1)。然而,与二级碳自由基IM1相比,一级碳自由基IM1’对芳基ipso位自由基进攻的活化能更高(14.7 vs. 11.2 kcal•mol-1)。理论计算结果表明,N-甲基C–H芳基化途径的决速步是碳自由基对芳基ipso位的自由基进攻,而N-α位亚甲基上C–H芳基化过程的决速步是HAT过程。值得注意的是,N-α位甲基C–H键芳基化的总活化能高于亚甲基位置C–H键芳基化的活化能(18.7 kcal•mol-1 vs. 16.9 kcal•mol-1),这表明亚甲基C–H芳基化在动力学上更容易进行, 这与实验现象一致。
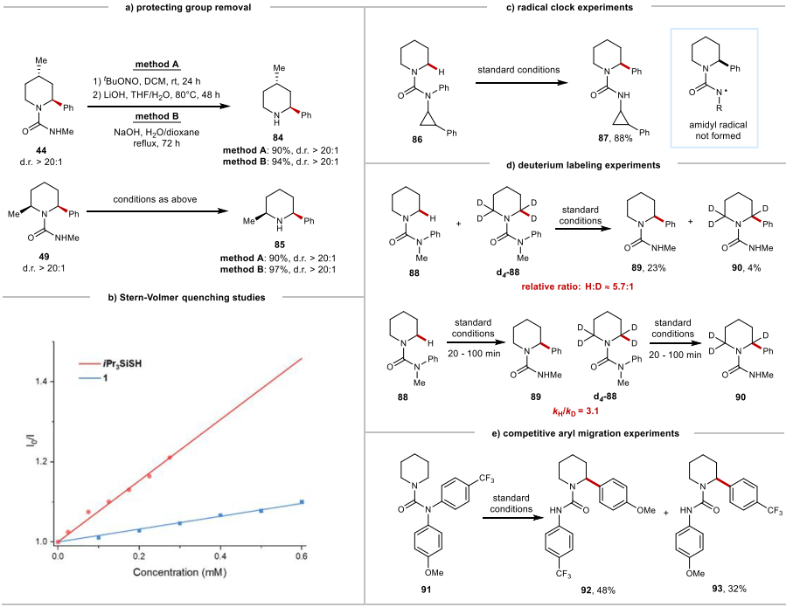
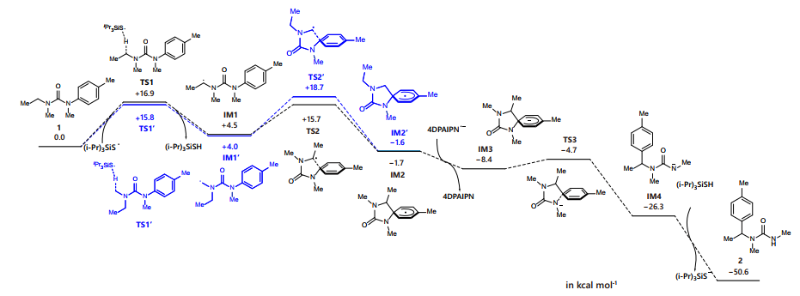
图4. 反应机理研究
根据机理研究和DFT计算结果,作者提出的推测机理如图5所示。4DPAIPN在蓝光照射下激发,被硫醇猝灭生成4-DPAIPN•-以及硫自由基(TIPS-S•)。TIPS-S•对亚甲基位置的HAT使硫醇催化剂再生,并通过过渡态TS1生成二级碳自由基IM1。接下来,自由基IM1对远端芳环进行ipso位自由基进攻,得到螺环自由基中间体IM2,它可以进一步被4-DPAIPN•-还原,得到环状共轭二烯阴离子中间体IM3,并再生光敏剂,结束光氧化还原循环。IM3在芳构化作用力驱动下发生芳构化C-N异裂,完成1,4-芳基迁移过程。最后,IM4快速质子化产生所需的芳基化产物2。
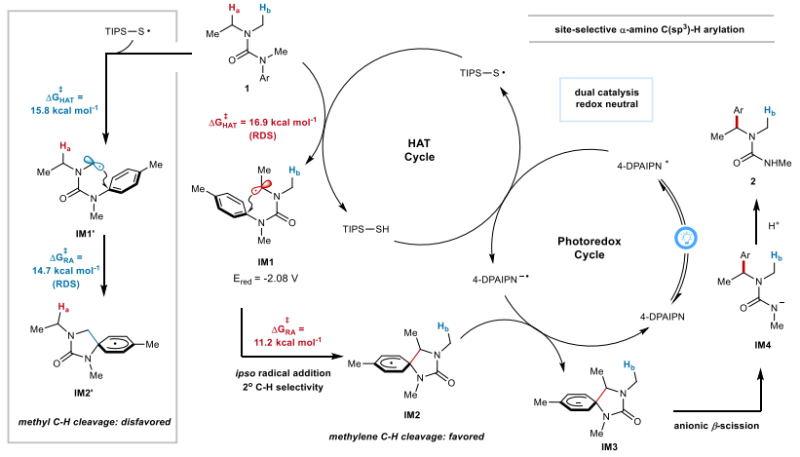
图5. 推测的反应机理
小结:蒋恒课题组与沈程硕课题组合作报道了一种位点选择性C(sp3)–H芳基化合成复杂苄胺类化合物的新方法。通过将光氧化还原与氢原子转移催化相结合,可以使二烷基胺经历位点选择性的N-α位HAT和N→C的自由基芳基迁移,将芳环选择性迁移至位阻较大的碳原子上。该反应具有较高的底物普适性,为复杂苄胺化合物的高效合成提供了一种新策略。机理研究结合DFT计算表明,该反应中2º和3º碳自由基发生芳基迁移所需活化能较低,这使得N-α位C–H芳基化具有优异的位点选择性。
作者简介:蒋恒博士,江苏宿迁人。2016年获得南京大学化学博士学位,师从张艳教授和俞寿云教授。攻读博士学位期间曾在Scripps研究所Jin-Quan Yu课题组交流(2014-2015)。2016-2020年在德国明斯特大学(WWU Münster)从事博士后研究工作,合作导师为Armido Studer教授。2021年2月进入上海交通大学药学院工作。蒋恒博士长期从事自由基化学、有机光化学研究,在J. Am. Chem. Soc.,Angew. Chem. Int. Ed.和Nat. Commun.等国际一流期刊上发表高水平论文20余篇。目前他的研究领域主要集中在:1)基于自由基转化的合成药物化学;2)近红外光促进的新型生物正交反应体系的开发。欢迎对相关研究方向感兴趣的博士后、研究生及研究助理加盟本组。
论文链接:https://www.nature.com/articles/s41467-024-51239-3#article-info