
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大薛向东课题组在Biomaterials发表cGAS/STING相关肿瘤免疫治疗研究新成果
近日,上海交大药学院薛向东研究团队在学术期刊Biomaterials上发表了题为“Manganese-coordinated nanoparticle with high drug-loading capacity and synergistic photo-/immuno-therapy for cancer treatments”的研究成果。

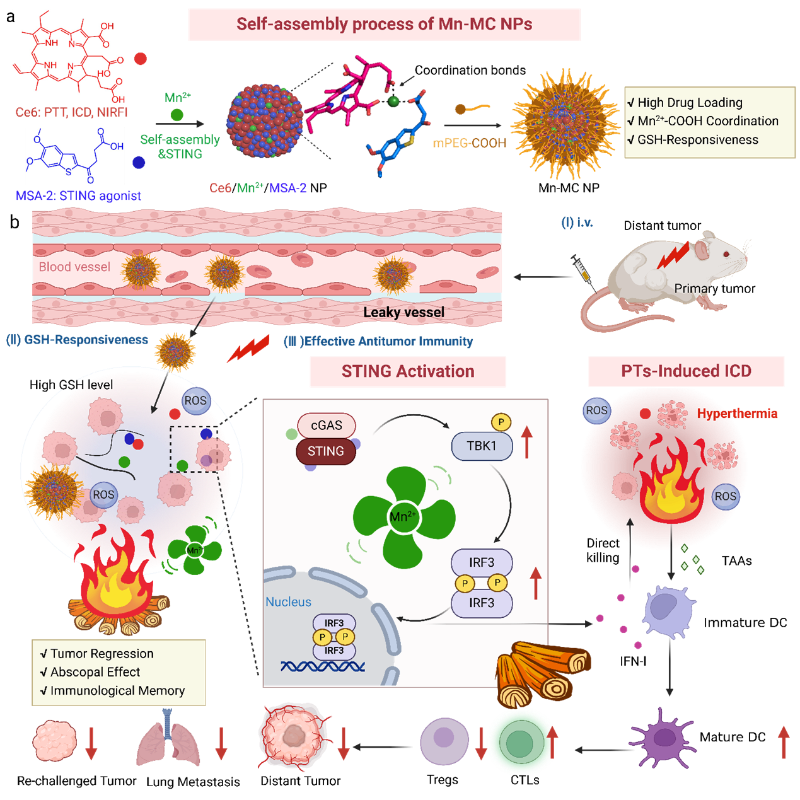
免疫治疗作为最有前景的肿瘤治疗方向,可通过激活机体抗肿瘤免疫应答以抑制肿瘤发展并预防复发。然而,因肿瘤内淋巴细胞浸润有限(即“冷”肿瘤)和免疫抑制的肿瘤微环境(TIME),导致其在临床治疗中的应答率较低。固有免疫应答的激活有望成为提高肿瘤免疫治疗有效策略。其中,先天免疫核酸感受通路中干扰素基因刺激蛋白STING对于逆转肿瘤微环境免疫抑制,提升免疫应答率至关重要。然而,系统给药后微弱的肿瘤富集效果和脱靶副作用等缺陷极大限制了小分子STING激动剂在各种恶性肿瘤的治疗应用。设计合适的药物载体对小分子STING激动剂进行精准递送,成为一种安全有效的新型免疫治疗策略。目前研究认为金属锰离子(Mn2+)可有效增强cGAS-STING信号,并通过金属配位作用驱动纳米颗粒的自组装行为。因此,开发基于锰配位的纳米颗粒可作为激活并增强基于STING抗癌免疫的有效策略。但具有“冷”和免疫抑制微环境的侵袭性肿瘤可能无法仅通过先天免疫治疗得到有效抑制。
针对以上科学难题,上海交通大学药学院薛向东研究团队构建了一种具有谷胱甘肽响应性的多重免疫刺激纳米平台(Mn-MC NPs)。该平台旨在高效递送小分子STING激动剂,并联合光热治疗,搭建先天免疫与适应性抗肿瘤免疫的桥梁以增强Mn2+驱动STING通路的免疫活性。该免疫刺激纳米颗粒由光敏剂(Ce6)和STING激动剂(MSA-2)通过Mn2+驱动配位,进一步聚乙二醇(PEG)化而成。在小鼠皮下肿瘤模型(乳腺癌和黑色素瘤)中,Mn-MC NPs在静脉注射后可通过被动靶向作用富集到肿瘤区域。在酸性和GSH过表达的肿瘤环境中,Mn-MC NPs被降解释放大量的Mn2+离子和STING激动剂,强烈而持久地激活cGAS-STING途径,从而引发先天抗肿瘤免疫;同时,Ce6发挥强大的光疗作用,促进肿瘤消融并诱导免疫原性死亡(ICD)效应,引发强烈的适应性抗肿瘤免疫。两者共同促进树突状细胞成熟,提高效应T细胞的增殖和浸润,增强抗肿瘤免疫反应,从而实现远处和转移性肿瘤的有效抑制。此外,它们还有助于通过促进长期免疫记忆来预防肿瘤复发。综上,本研究有望通过构建多重免疫刺激纳米颗粒,有效克服抗肿瘤免疫不足和癌症治疗无效的局限性。
该研究成果近期于生物材料期刊 Biomaterials 上发表,上海交通大学药学院陈晗及曲海晶为该论文的共同第一作者,薛向东和曲海晶为本文通讯作者。
薛向东,上海交通大学长聘教轨副教授,课题组组长,博士生导师。博士毕业于中国科学院国家纳米科学中心,师从梁兴杰研究员。2015年至2020年,分别在美国华盛顿大学和加州大学戴维斯分校从事博士后研究工作。2020年12月加入上海交通大学药学院,长期致力于:纳米药物制剂的开发及其对癌症等疾病的精准诊疗。目前已发表高水平SCI论文60余篇,论文被引4100余次,H因子31。包括以第一或通讯作者在Nat Nanotechnol, Nat Commun, Adv Mater, ACS Nano, Nano Lett, Biomaterials, J Control Release等国际权威刊物上发表的论文。申请PCT 国际专利 2项,中国专利 8 项。同时,薛向东为Exploration首届青年编委,Biomater Transl和iRadiology 期刊青年编委,中国药学会生化与生物技术药物专业委员会青年委员,中国抗癌协会纳米肿瘤专业委员会青年委员,上海市药学会药剂学专委会青年委员(基础药剂学组)。
论文链接:https://www.sciencedirect.com/science/article/pii/S0142961224002795
课题组主页:https://www.x-mol.com/groups/xiangdong_xue