
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大沈琦研究团队在仿生细菌金纳米笼用于癌症免疫治疗研究中获重要进展
近日,上海交大药学院沈琦研究团队在学术期刊Journal of Controlled Release发表了题为“Biomimetic gold nanocages incorporating copper-human serum albumin for tumor immunotherapy via cuproptosis-lactate regulation”的研究成果。

近年来,免疫治疗作为创新肿瘤疗法备受关注,其利用免疫系统阻断免疫抑制或触发免疫反应显示出潜力,多模式方法可以通过协同机制增强疗效。
铜死亡是由铜离子与线粒体蛋白质结合引起的细胞死亡,并通过免疫原性细胞死亡(ICD)刺激抗肿瘤免疫。肿瘤依赖糖酵解反应产生大量乳酸,抑制免疫反应并形成免疫抑制微环境。金纳米笼(AuNCs)在肿瘤纳米医学中具有光学调谐性、光热效应、活性氧(ROS)生成和精确药物递送等优势。在近红外(NIR)激光下,AuNCs通过抑制糖酵解酶降低乳酸水平,增强铜死亡敏感性并逆转免疫抑制。生物仿生纳米技术,特别是使用细菌膜囊泡(BMVs)进行纳米粒子涂层,能显著提高纳米制剂的稳定性、靶向性和疗效,使其成为肿瘤治疗的新方法。
为此,上海交通大学药学院沈琦研究团队提出了一种新型的铜死亡调控策略,通过构建仿生金纳米笼(BAu-CuNCs)并加以NIR,调控铜死亡-乳酸相关通路,为基于铜死亡的肿瘤免疫治疗提供了一种新策略。
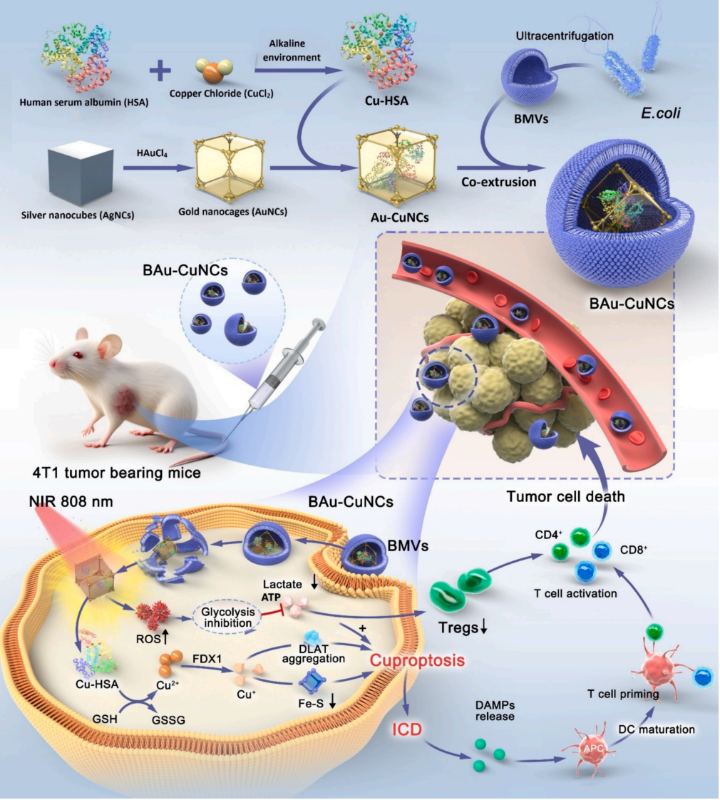
本研究构建了铜死亡-乳酸调节治疗性纳米系统(BAu-CuNCs),以引发铜死亡并增强抗肿瘤免疫力,用于癌症治疗。为了在肿瘤细胞内转运Cu2+离子并促进铜死亡,首先通过Cu2+离子与HSA的硫醇(SH)部分半胱氨酸残基反应制备Cu-HSA。为了提高稳定性,增强功效和靶向性,将CuHSA进一步掺入AuNCs中,并在外表面涂上细菌膜涂层以生产BAu-CuNCs。通过铜死亡随后导致ICD,CD8+和CD4+免疫T细胞的显着增殖激活抗肿瘤免疫。同时,AuNCs在NIR下促进肿瘤细胞中ROS的过度生成,从而阻断糖酵解代谢途径。
上海交通大学药学院博士研究生Hajra Zafar为该论文的第一作者。该论文通讯作者为沈琦研究员。本研究得到了重庆市自然科学基金(批准号:CSTB2022NSCQMSX1358和CSTB2023NSCQ-MSX0959)和上海市药物靶标发现及递送前沿科学研究基地面上项目(批准号:ZXWH2170101)的支持。