
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大朱峰团队发文:钯催化新型稳定的糖烯基硼试剂参与的Suzuki-Miyaura交叉偶联反应
C-糖苷结构相比传统的O-糖苷和N-糖苷通常更为稳定,因此在体内具有优异的生物稳定性,不易受到水解酶的降解影响。这使得研究和合成C-糖苷在药物化学和天然产物化学中具有重要意义(图1a)。作为合成多种C-糖苷类化合物和天然产物的关键中间体(见图1b),开发简洁高效的方法来获取C-1糖烯是非常必要的。C-1糖烯基硼试剂参与的Suzuki-Miyaura交叉偶联反应由于其反应条件温和、高效且适用范围广泛,因而受到广泛关注和应用;已成功合成了许多天然C-糖苷分子(图1c)。然而,目前糖烯基硼的规模化制备仍然是一个重大挑战。由于C-1糖烯基硼的富电子不饱和烯醇醚结构,其稳定性较差,纯化困难,常需特殊实验操作和处理。这种特性使得多糖烯基硼化合物的合成尚未实现,并且在生物兼容条件下利用糖烯基硼试剂对复杂分子进行后期糖修饰尚未见报道。因此,开发既具备良好稳定性又具有优异反应活性的糖烯基硼试剂,以在温和条件下实现C-1糖烯的高度模块化合成,具有重要的科学意义和应用潜力。

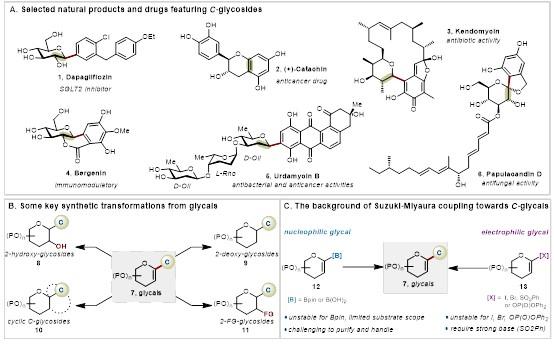
图1. 研究背景
针对上述难题,上海交通大学变革性分子前沿科学中心朱峰课题组以 1,1,2,2-四乙基乙二醇和(+)-蒎烷二醇为硼酸保护基,开发了两类兼具稳定性和反应性的糖烯基硼试剂,成功实现了一种高度模块化的钯催化糖烯基型的Suzuki-Miyaura交叉偶联反应。该方法能够在较为温和的反应条件下,以良好至优异的产率稳健地构建Csp2-Csp、Csp2-Csp2和Csp2-Csp3键(图2)。
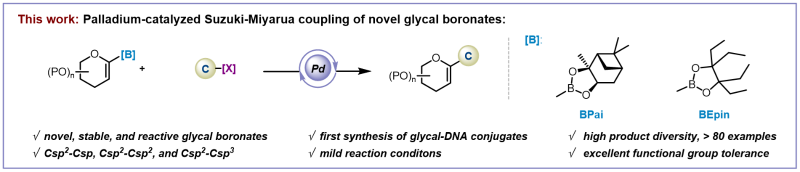
图2. 研究方法
首先,在最优条件下,作者对该反应中的亲电试剂范围进行了全面考察(图3)。结果表明,此反应能够兼容多种不同类型的官能团,包括吸电子、给电子基团或杂环,以及活性官能团(如羟基、胺基、羧基等)。同时,作者还挑战了更具难度的寡肽分子,令人高兴的是,这些底物在温和的反应条件下也能顺利地得到目标产物。为了验证该方法的普适性,作者进行了药物分子和天然产物的后期糖修饰,能以中等至良好的收率得到目标产物。随后,作者将这一方法拓展到生物大分子的糖修饰,发展了首例DNA兼容的Suzuki-Miyaura型糖基交叉偶联反应,成功合成了多种新型的糖烯-DNA缀合物。此外,还开发出一锅法策略,实现了糖烯分子的C-H硼化与交叉偶联反应的串联,一步实现了不同糖烯分子的C-糖苷化。

图3 反应底物拓展与一锅法合成
最后,为探索该策略的合成实用性,作者进行了产物后期的多样性衍生化实验(图4)。首先实现了糖尿病药物分子达格列净和托格列净的合成;同时对所合成的药物分子-糖烯产物进行了双键的转化,构建出新的C-糖苷潜在药物活性分子;接着通过对反应产物进行多步修饰,成功合成了托格列净药物分子及其异构体,进一步证明了当前方法的实用性。
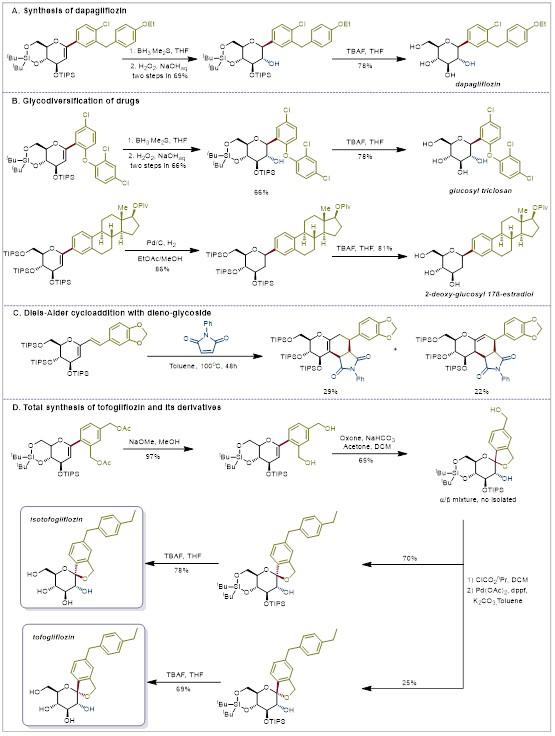
图4 后期衍生化与合成
在该工作中,朱峰课题组在创制新型稳定的糖烯基金属试剂方面取得了重要突破,有效解决了糖烯型Suzuki-Miyaura偶联反应中存在的试剂稳定性挑战。该方法具有优异的反应活性、稳定性、通用性和操作简便等特点,因此在C-糖苷药物分子和天然产物的制备中具有广泛应用的潜力。
上述研究成果近期以“Palladium-catalyzed Suzuki-Miyaura cross-couplings of stable glycal boronates for robust synthesis of C-1 glycals”为题发表在Nat. Commun.。 变革性分子前沿科学中心博士生陈安荣为论文的第一作者;朱峰副教授和朱利娟副研究员为论文共同通讯作者。上述研究工作得到了科技部重点研发项目青年科学家项目、国家自然科学基金和上海市科委等的资助。
原文链接:https://doi.org/10.1038/s41467-024-49547-9