
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大微生物代谢国家重点实验室团队发现链霉菌抗生素调控蛋白激活转录的分子机制
近日,上海交通大学生命科学技术学院、微生物代谢国家重点实验室郑舰艇课题组在国际知名期刊《PLoS Biology》上发表题为“Structural and functional characterization of AfsR, an SARP family transcriptional activator of antibiotic biosynthesis in Streptomyces”的研究论文。作者通过冷冻电镜技术和体外生化实验展示了链霉菌抗生素调节蛋白(SARP)家族AfsR如何激活抗生素生物合成基因的转录,以及受其NOD和TPR结构域调控。上海交通大学生命科学技术学院博士生王逸群为论文第一作者,上海交通大学生命科学技术学院郑舰艇副教授为该论文通讯作者。
抗生素是人类医学领域的重要药物,但由于过度使用和滥用,导致了抗生素耐药性的问题。因此,寻找新的抗生素生物合成途径成为了当前研究领域的热点。然而,如何激活抗生素合成基因的转录仍然存在许多未知的问题。链霉菌抗生素调节蛋白 (SARP)是这些天然产物生物合成中的关键起始因子和激活剂。AfsR 是一种 SARP 家族调节因子,具有额外的核苷酸结合寡聚化结构域 (NOD) 和四肽重复序列 (TPR) 结构域,因其在抗生素生物合成中的重要作用而被发现。
该论文首先运用冷冻电镜技术,成功解析了SARP转录起始复合物的结构,进而揭示了SARP家族蛋白如何识别次优启动子并激活转录的分子机制。AfsR通过其SARP结构域与启动子的-35区附近结合,并与RNAP核心酶的α、β、β’亚基在多个区域发生相互作用。其中,两个SARP单体均参与了与α亚基C末端的相互作用,从而招募RNA聚合酶,实现转录的激活。同时,SARP为σ因子的区域4提供了一个替代的结合位点,以规避识别不保守的-35区以及过长的-10和-35区之间的间隔,被称为σ因子适应机制。
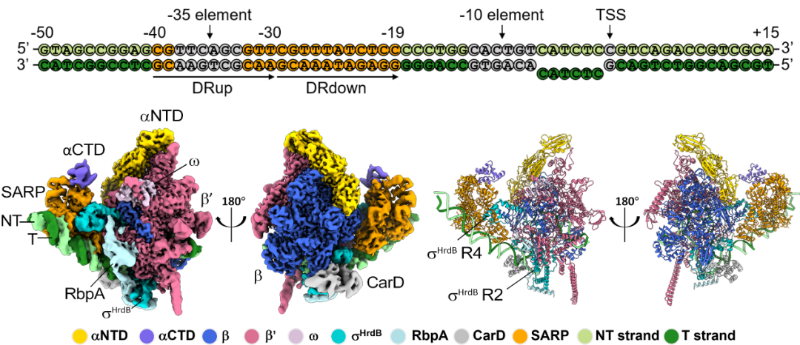
随后,经过体外测定,本研究证实了AfsR的C端NOD和TPR结构域对转录激活功能具有抑制作用。然而,当ATP结合时,这种抑制作用被显著消除。进一步的质谱检测揭示,AfsR存在四个保守的磷酸化位点。尽管磷酸化仅轻微提升了AfsR的转录激活活性,但却完全消除了ATP结合带来的去抑制作用。这可能是由于磷酸化引发了构象变化并提升了ATP酶活性。
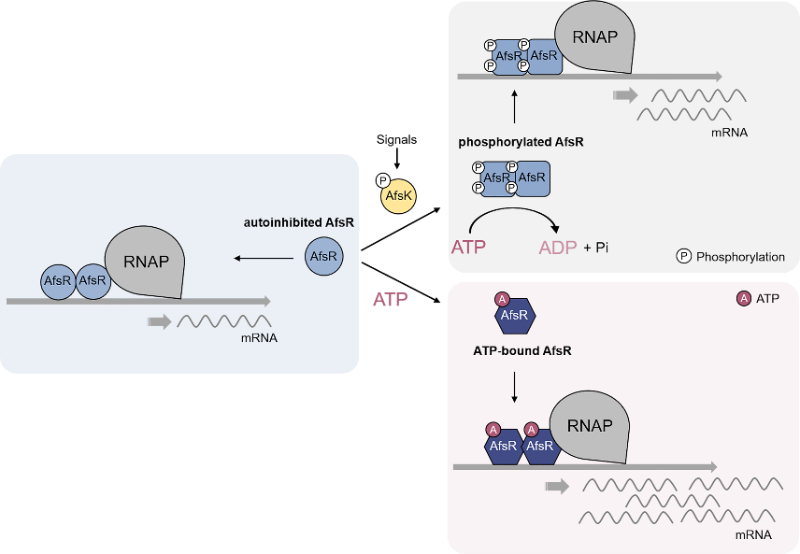
综上,本研究揭示了AfsR作为一种SARP家族转录激活因子的结构和功能,为深入研究抗生素生物合成提供了新的思路。此外,本研究还发现了AfsR的NOD和TPR结构域对其转录激活作用的调控作用,为研究其他多结构域SARP家族蛋白的调控机制提供了新的参考。
本项目得到了国家重点研发计划、国家自然科学基金的资助。感谢上海交通大学分析测试中心电镜中心和质谱平台的技术支撑。
论文链接:https://doi.org/10.1371/journal.pbio.3002528