
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大药学院研究团队与华师大研究团队合作发现GPR183抑制剂
氧甾醇受体GPR183是一种由 361 个氨基酸残基组成的类视紫红质GPCR, 其在B 细胞、T 细胞、树突状细胞(DC)和先天性淋巴细胞等多种免疫细胞中高度表达。胆固醇氧化代谢产物 7α,25-二羟基胆固醇(7α,25-OHC)是其最强效的内源性配体。已有研究表明,GPR183 在炎症性肠病(IBD)的发生发展过程中起着关键作用。阻断GPR183受体介导的第3组先天淋巴细胞(ILC3s)等肠粘膜免疫细胞的过度活化,进而抑制机体过度的适应性免疫反应,可能为IBD等自身免疫性疾病的治疗提供新的药物研发策略。目前针对GPR183开发的小分子抑制剂较少,由诺华公司在2014年报道的小分子NIBR189为首个被确证靶向GPR183的高效抑制剂。最近,南京艾美斐公司报道的GPR183小分子抑制剂在类风湿性关节炎疾病小鼠模型中表现出较好的疗效。值得注意的是,GPR183抑制剂在肠道炎症性疾病中(如IBD)的治疗潜力尚不明确。
近日,上海交通大学药学院张翱研究团队与华东师范大学生命学院卢伟强研究团队紧密合作,在靶向GPR183小分子抑制剂治疗严重性肠病的研究中取得进展。该工作最近在线发表在国际知名学术期刊Journal of Medicinal Chemistry, 2024, 67(5): 3520-3541.
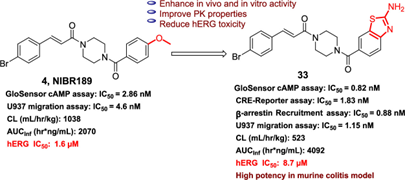
Figure 1. Discovery of the new GPR183 antagonist 33.
首先,研究团队以GPR183 拮抗剂NIBR189为先导化合物,针对其潜在的hERG心脏毒性进行了系统的结构优化,包括插入碳原子、引入桥环、并环及环化等药化修饰策略。其中,含氨基苯并噻唑结构的化合物 33被鉴定为一种高效的 GPR183拮抗剂 (Figure 1)。
化合物33能够强效抑制GPR183受体下游信号Gαi和β-arrestin的活化,IC50 值分别为 1.83 nM 和 0.88 nM。在人类 GPCRome 试验中,化合物33对其他163种GPCR无显著抑制活性,但能特异性地抑制GPR183受体,表明化合物 33具有高度的靶点选择性。在安全性与成药性方面,与NIBR189 相比,化合物 33 的 hERG 心脏毒性显著降低(8.71 vs 1.8 μM),药代动力学特性也有所改善。在DSS诱导的小鼠肠炎模型中,口服化合物33剂量依赖性地改善了炎症反应和肠道损伤,小鼠体重未见明显下降。从HE染色结果可看出,化合物33明显改善了小鼠肠炎模型中由DSS诱导所引起的粘膜损伤、溃疡、隐窝结构缺失和炎性细胞浸润等病理变化 (Figure 2)。这项研究证明了阻断 GPR183受体能够有效减缓 IBD发展进程,兼具高药效活性与安全性的新型化合物 33 有望成为治疗IBD的临床前候选药物。
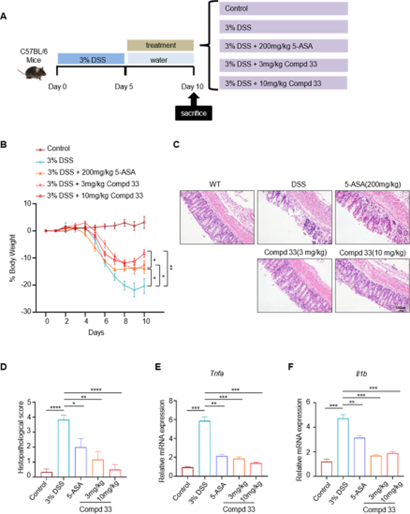
Figure 2. In vivo anti-inflammatory activity of compound 33 in dextran sulfate sodium (DSS)-induced murine colitis.
本论文的第一作者是上海市药物靶标发现及递送前沿科学研究基地博士生曾若晴和华东师范大学生命科学学院博士生方美苗以及温州医科大学联培生沈安成。通讯作者分别为上海交通大学张翱教授、华东师范大学卢伟强研究员、以及上海交通大学宋子兰副研究员。该工作受到国家自然科学基金、上海张江国家自主创新重大项目和转化医学国家重点实验室(上海)等支持。本项目还得到了华东师范大学刘明耀教授和瑞金医院冯波主任和芮炜玮主任的大力帮助。
论文链接:https://doi.org/10.1021/acs.jmedchem.3c01905