
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大药学院研究团队和华师大研究团队合作发现KRAS G12D抑制剂
Kirsten大鼠肉瘤病毒癌基因(Kirsten Rat Sarcoma Viral Oncogene Homolog,KRAS)是RAS家族最常发生突变的亚型,曾一度被认为是“不可成药”的靶标。近年来,靶向KRASG12C突变的共价变构抑制剂取得了重大突破,两款小分子抑制剂AMG510(Sotorasib)以及MRTX849(Adagrasib)先后获美国FDA批准上市,从而掀起靶向难成药靶标KRAS的药物研究热潮。然而,针对KRASG12C之外的其他突变目前仍无药物上市,尤其是在多种肿瘤中广泛存在的KRASG12D。近期,Mirati公司开发的MRTX1133作为首款口服可逆型靶向KRASG12D抑制剂刚刚进入临床I期,极大地推动了该突变靶点的药物研究。
近日,上海交通大学药学院张翱研究团队与华东师范大学生命学院逄秀凤研究团队紧密合作,在靶向KRASG12D突变的抗肿瘤小分子抑制剂研究中取得进展。该工作最近在线发表在国际知名学术期刊Journal of Medicinal Chemistry:https://doi.org/10.1021/acs.jmedchem.3c01724。
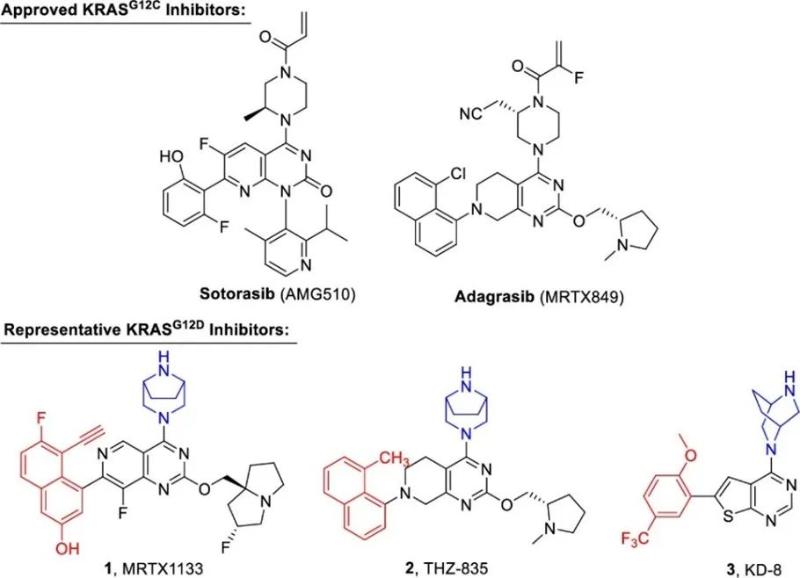
Figure 1. Approved KRASG12C inhibitors and representative KRASG12D inhibitors.
在这项研究中,研究者基于MRTX1133的复合物晶体结构,一方面针对其碱性氮杂桥环片段占据的P loop区域、分子左侧萘环作用的疏水口袋以及吡咯里西啶双环作用的溶剂区三个部分,进行了系统的结构优化。尤其是,针对苄氧位亚甲基这一潜在代谢位点进行氘代以期增加化合物的稳定性,同时引入偕二氟烯烃取代基增加分子新颖性,最终获得了一类具有偕二氟烯烃取代的吡咯里西啶氘代化合物22和28。
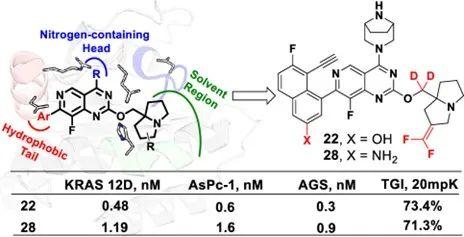
Figure 2. Structure-based drug design of new KRASG12D inhibitors.
化合物22和28对表达KRASG12D突变的AsPc-1和AGS等细胞株表现出低纳摩尔级别(0.3-1.6 nM)的生长抑制活性,对其他KRASG12S突变株A549以及KRASWT H1299细胞活性较弱,显示对KRASG12D较好的选择性。随后,通过构建基于均相时间分辨荧光(HTRF)的试验,发现化合物在分子水平高活性抑制RAF-RAS蛋白相互作用(IC50 = 0.48 – 1.19 nM)。进一步在人胰腺癌细胞AsPc-1和肠癌细胞AGS中,新化合物剂量依赖性显著抑制KRAS下游蛋白ERK和AKT的磷酸化。流式细胞分析同样显示,经由化合物(50 nM)处理24小时后的凋亡细胞百分比约为空白对照组的2倍。在AsPC-1小鼠异种移植瘤小鼠模型上,新化合物在腹腔给药20 mg/kg每日两次的条件下,对肿瘤生长抑制率(TGI)分别达到73.4%和71.3%,同时小鼠体重并没有明显的变化。将肿瘤组织进行Western-Blot分析表明,新化合物在体内显著抑制KRAS下游蛋白ERK和AKT的磷酸化。综上,这表明该类化合物具有良好的安全性和抗肿瘤活性,具有进一步研究潜力。
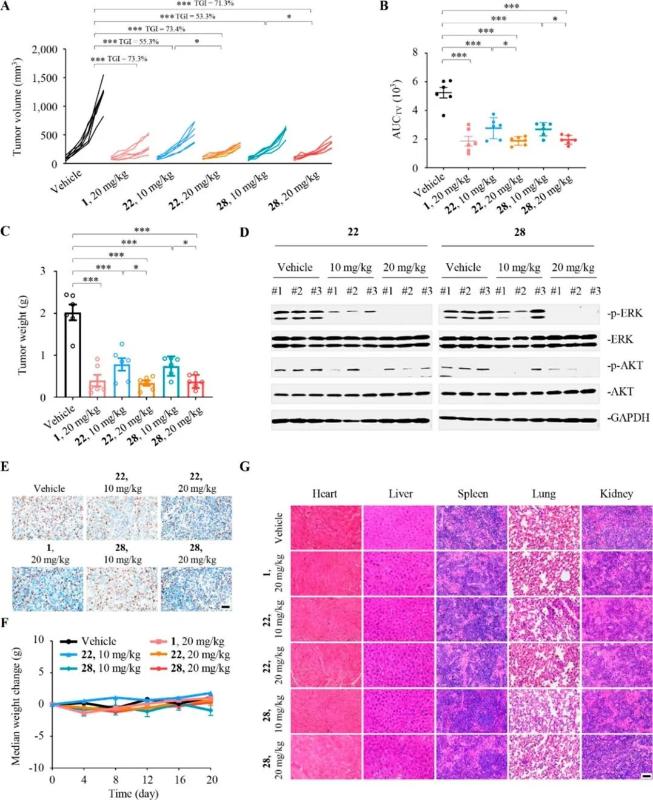
Figure 3. Anti-tumor effects of compounds in tumor xenograft mouse models in vivo.
本论文的第一作者是上海交通大学药学院博士研究生肖宣政以及华东师范大学生命科学学院博士后冯娟娟。通讯作者分别为张翱教授以及逄秀凤教授。该工作受到国家科技创新2030项目、国家自然科学基金面上项目以及上海张江国家自主创新重大项目等支持。
论文链接:https://doi.org/10.1021/acs.jmedchem.3c01724