
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大张岩课题组发现BRS-3受体新型激动剂并揭示其血糖稳态调节机制
蛙皮素受体亚型-3(bombesin receptor subtype 3, BRS-3,也称BB3)是孤儿受体,与胃泌素释放肽受体(gastrin-releasing peptide receptor, GRPR,也称BB1)和神经介素B受体(neuromedin B receptor,NMBR,也称BB2)同属于蛙皮素样受体(bombesin-like peptide receptor)家族。尽管与BB1和BB2分别有51%和47%的序列同源性,但已有研究表明BRS-3具有独特的药理作用,导致其对所有已知的天然蛙皮素样肽的亲和力都非常微弱;同时,内生配体的缺乏,给BRS-3在生理病理功能方面的研究带来极大阻碍。尽管如此,BRS-3受体长期受到工业界和学术界的关注,这与其所表现出的调节体内能量代谢平衡和葡萄糖稳态密切相关,使其有望成为治疗II型糖尿病的新型靶点。虽然已报道的BRS-3激动剂可以降低实验动物的体重并调节其血糖稳态,但是由于这些激动剂能够同时激动脑中的BRS-3,存在潜在的心血管方面的副作用。因此,亟需发现新的外源性配体对BRS-3进行概念验证研究,更加全面、充分地对BRS-3进行靶点确证,探究仅激动外周BRS-3的激动剂是否可以改善糖尿病模型小鼠的血糖稳态。
在前期BRS-3配体及功能的研究基础上(Cellular and Molecular Life Sciences 2022, 79, 72; Phytomedicine 2022, 100, 154085; Journal of Proteome Research 2020, 19, 1513-1521),上海交通大学药学院张岩课题组联合药学院李绍顺教授团队、生命科学技术学院肖华教授团队,发展了一系列含萘醌肟结构新型骨架的BRS-3选择性小分子激动剂,其中DSO-5a激动效果最强(IP-1测试中EC50≈3.8 nM),并可有效改善正常小鼠和糖尿病db/db小鼠的血糖稳态。药代动力学表明,DSO-5a穿过血脑屏障能力差,表明作用于外周BRS-3受体的小分子激动剂仍可以调节体内血糖稳态,并可能避免作用于中枢带来的副作用。进一步采用DSO-5a作为分子探针,通过定量蛋白质组学方法研究了BRS-3介导的信号通路,发现PPAR-gamma是一种由BRS-3介导的新型信号通路,对于调节体内葡萄糖稳态可能发挥着重要作用。该研究成果为II型糖尿病新型靶点的确认以及治疗提供了新策略。
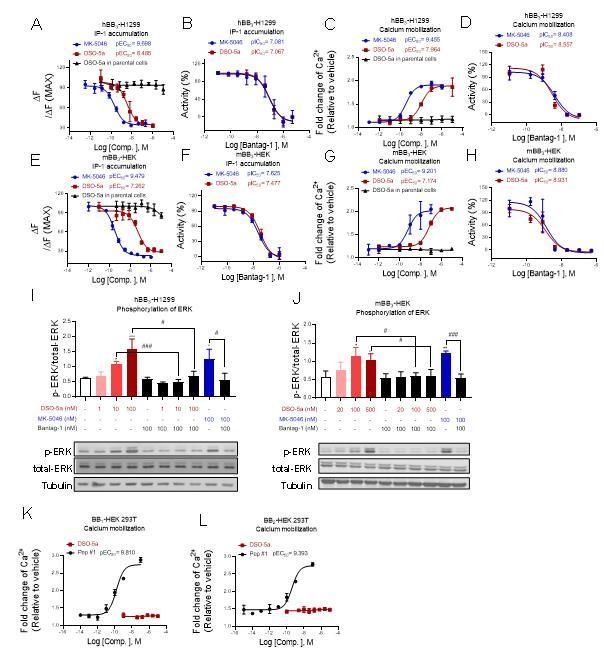
图1. DSO-5a细胞水平特异性激动BRS-3(BB3)受体
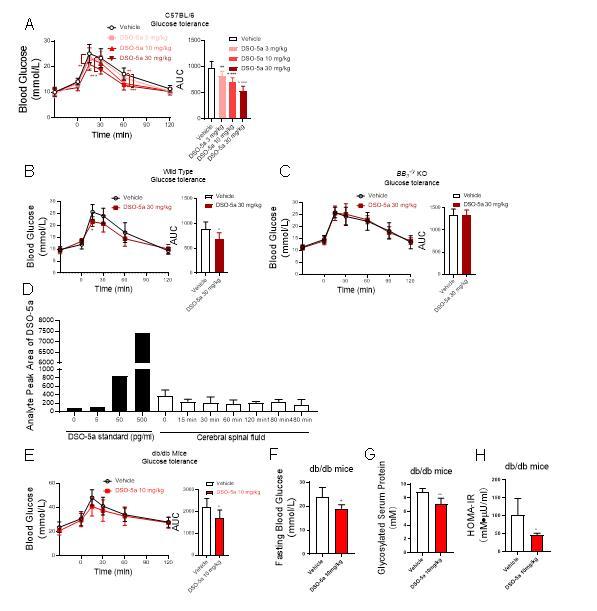
图2.DSO-5a在动物体内改善血糖稳态
近日,相关研究工作以“Discovery of Dimethyl Shikonin Oxime 5a, a Potent, Selective Bombesin Receptor Subtype-3 Agonist for the Treatment of Type 2 Diabetes Mellitus”为题在线发表在药物化学国际知名期刊Journal of Medicinal Chemistry上。该论文通讯作者为上海交通大学药学院张岩副教授和上海交通大学生命科学技术学院肖华教授。该论文的共同第一作者为上海交通大学药学院研究生吴乐昊(已赴美国普渡大学继续深造)、上海交通大学化学化工学院崔家华助理研究员。该研究得到上海交通大学药学院李绍顺教授和化学化工学院贾金平教授的支持。
该研究工作得到了上海市自然科学基金、国家重点研发计划、国家自然科学基金等项目资助。
论文链接:https://pubs.acs.org/doi/full/10.1021/acs.jmedchem.3c00323