
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大药学院研究团队合作发现肿瘤靶向的光控STING激动剂
靶向免疫检查点的抗肿瘤免疫疗法在临床上已获得巨大成功,但患者总体响应率较低。临床研究表明,免疫检查点抗体治疗的有效性取决于肿瘤预先存在的抗肿瘤T细胞反应。其中,先天免疫核酸感受通路中干扰素基因刺激蛋白STING对于T细胞抗肿瘤效应至关重要。但由于STING在全身各组织器官均有表达,系统性激活STING可能导致全身细胞因子风暴而产生毒副作用。因此,STING激动剂抗肿瘤研究存在挑战,如何安全、有效地特异性激活肿瘤部位STING是当前STING激动剂临床研究的重要方向。
针对这一科学难题,上海交通大学药学院/创新免疫治疗全国重点实验室张翱研究团队在前期cGAS-STING调节剂研究基础上(Acta Pharm Sin B 2020, 10, 2272-2298; J Med Chem 2021, 64, 1649-1669;J Med Chem 2021, 64,7667-7690)联合药学院经莉莉课题组和中科院上海药物研究所谢作权研究小组,发展了一种新型碳酸酐酶靶向的光控STING激动剂偶联物,成功实现特异性地激活肿瘤部位的STING。相关研究工作以“Photochemically controlled activation of STING by CAIX-targeting photocaged agonists to suppress tumor cell growth”为题最近在线发表在英国化学会旗舰期刊Chemical Science (https://doi.org/10.1039/D3SC01896B)。
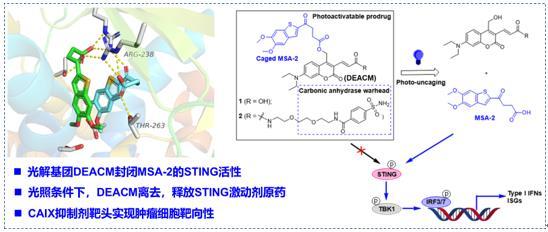
图1. 碳酸酐酶靶向的光控STING激动剂的设计
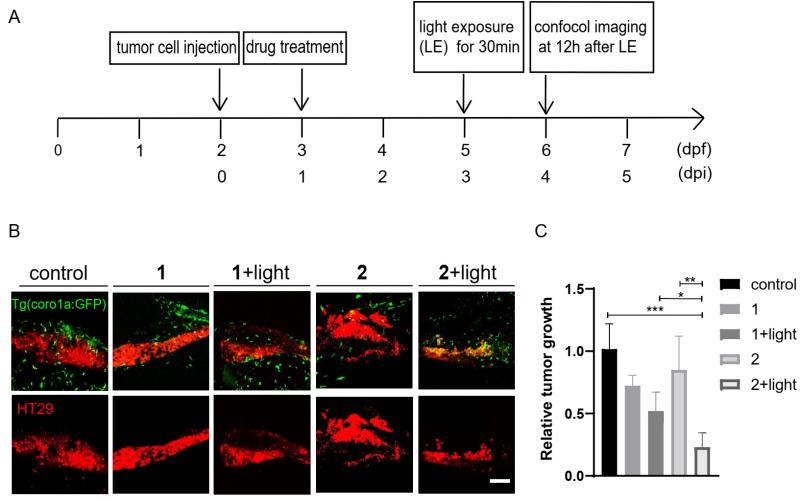
图2. 光控STING激动剂在斑马鱼异种移植瘤模型中抗肿瘤免疫效果
在该研究中,联合研究团队首先利用具有高量子产率和水溶性的香豆素类光裂解基团(DEACM)与STING激动剂MSA-2的羧基药效团进行酯化偶联,封闭STING活性,得到光笼型分子1。该分子在450 nm可见光照射下,可时间依赖地释放STING激动剂。考虑到碳酸酐酶IX(CAIX)在多种肿瘤中特异性表达,团队进一步在DEACM骨架中引入芳基磺酰胺类CAIX靶头,以增强肿瘤靶向性,获得光控STING激动剂偶联物2(图1)。该分子在THP-1细胞和斑马鱼胚胎中能以光照依赖的方式释放STING激动剂,激活STING及其下游信号通路,且具有一定时间和浓度依赖性。接着团队采用了斑马鱼异种移植瘤模型评价了2在体内的肿瘤靶向性、抗肿瘤效应和毒性反应。相对于不携带CAIX靶头的1,光控STING激动剂偶联物2能够特异性靶向肿瘤细胞组织,并在可见光照射下激活斑马鱼STING,活化免疫效应细胞,产生更强肿瘤生长抑制活性(图2)。此外,相对于free激动剂,偶联物2还具有显著降低的系统性免疫激活毒性。该研究为深入探索STING激活机制提供新工具分子,也为基于STING激活的抗肿瘤免疫精准治疗提供新思路和策略。
该论文通讯作者为上海交通大学特聘教授张翱、长聘教轨副教授经莉莉和研究员丁春勇,以及中科院上海药物研究所副研究员谢作权。该论文的共同第一作者为上海交通大学药学院/张江高等研究院研究员丁春勇、联培生熊智、硕士生汪雪以及中科院上海药物研究所博士生杜梦妍。该研究得到上海交通大学邓刘福教授和华东师范大学徐志爱教授的支持,还受到上海交通大学“双一流”学科建设项目、重点前瞻布局基金以及国家自然科学基金等支持。