
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大吴华课题组在Angewandte Chemie发表不对称催化1,2-重排反应最新研究成果
2023年3月3日,上海交通大学药学院吴华课题组在国际著名学术期刊Angewandte Chemie上发表了题为“Asymmetric Construction of α,α-Disubstituted Piperazinones Enabled by Benzilic Amide Rearrangement”的研究论文,开发了兼具新颖性和实用性的不对称1,2-重排反应,即首例不对称催化benzilic amide重排,并基于此成功实现了极具合成挑战性和重要性的手性α,α-双取代哌嗪酮分子的高立体选择性构建。该工作得到了审稿人的高度评价(论文重要性TOP 5%),并被评选为VIP(Very Important Paper)论文。

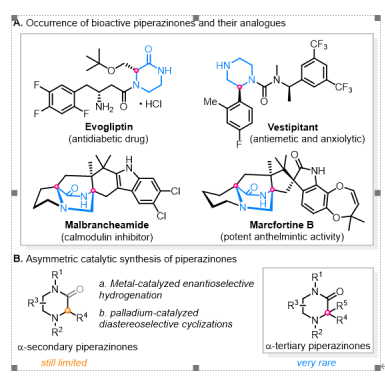
图1 哌嗪酮骨架及其立体选择性合成
哌嗪酮及哌嗪骨架是众多药物分子和活性天然产物的关键结构单元和常见药效基团,如 Evogliptin(降糖药)、Vestipitant(止吐药和抗焦虑药)、Malbrancheamide(钙调蛋白抑制剂)和Marcfortine B(强效驱虫活性)等。在合成方面,目前从手性源出发的不对称诱导反应是主要策略,但对于产物结构限制较大,而不对称催化制备方法仍然有限,且基本局限于手性α-单取代哌嗪酮的合成,关于α,α-双取代哌嗪酮的对映选择性构建则鲜有报道,仅有的几例合成方法也基本都是从它们结构相似的环状前体出发获得。
不对称催化1,2-重排是立体选择性构建碳碳键及碳杂键的重要方法,近年来得到了一定发展。然而,用于合成手性胺的对映选择性1,2-重排反应却非常少见,特别是α-叔胺的对映选择性构建尚未实现,主要存在以下挑战:(a) 空间位阻大,反应活性低;(b) 不涉及小环张力释放过程,缺乏驱动力;(c) N-取代基的朝向不确定,难以区分酮亚胺的两个潜手性面;(d) 底物结构复杂、稳定性差。
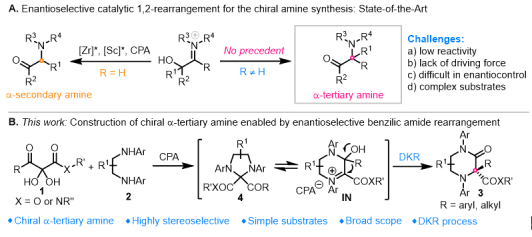
图2 不对称1,2-重排反应用于手性胺的构建
该课题组通过发展新型不对称催化benzilic amide重排反应,从简单易得的链状非手性起始原料出发,基于有机催化模式,成功实现了该类含氮杂季碳中心哌嗪酮骨架的高效、高立体选择性构建。在最优条件下,作者对三羰基底物以及1,2-二胺衍生物的适用范围进行了考察,结果表明反应对强吸电子芳基、强给电子芳基、烷基(甲基)、药物分子衍生物以及酰胺类三羰基衍生物等都有非常好的兼容性,同时对于光学纯的环己二胺衍生物仍然能够得到很好的立体选择性控制结果。此外,在整个串联反应过程中,水为唯一副产物。
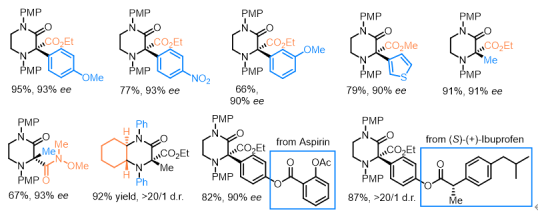
图3.部分底物范围
通过一系列机理研究表明,该转化经历高度有序的串联反应过程,即咪唑啉化/形式上的1,2-氮迁移/1,2-芳基或烷基迁移。值得注意的是,该反应的立体选择性控制步骤可能在1,2-碳迁移过程,且以动态动力学拆分的方式得以实现。在此反应中,手性 BINOL 衍生的磷酸根能够通过动态动力学拆分方式有效区分手性α-亚胺半缩醛胺离子中间体,从而实现高立体选择性的1,2-芳基/烷基迁移反应。
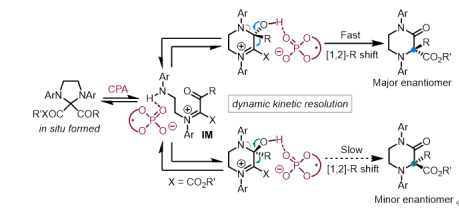
图4. 可能的反应机理
该新型不对称1,2-重排反应具有以下优点:1、双分子反应且原料简单易得;2、原位产生复杂重排前体,无需分离;3、底物范围广;4、水为唯一副产物。该策略的进一步开发不仅能够为其它常规方法难以获得的重要手性杂环分子的高效合成提供强有力的工具,而且能够为不对称催化1,2-重排反应的实用性和系统性研究提供重要参考。目前,该类新型手性哌嗪酮分子的药效研究正在进行,欢迎合作。
上海交通大学药学院何玉萍博士和硕士研究生权睿为该论文的共同第一作者,上海交通大学药学院吴华(长聘教轨副教授,课题组长)为该论文的唯一通讯作者,上海交通大学药学院博士研究生李幸子,瑞士洛桑联邦理工学院的祝介平教授为该论文的共同作者。该工作得到了国家自然科学基金、国家相关人才计划、上海交通大学以及博士后面上基金的资助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202217954