
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大薛红卫课题组与合作者揭示磷脂酸细胞器间转运进而调控叶绿体发育的机制
光合真核生物将太阳能转化成化学能,这一过程为地球生命提供了赖以生存的食物和能量。叶绿体内囊体膜是实现光合作用过程的必要场所,并由合适的脂类组装以保证其功能的发挥。磷脂酸(phosphatidic acid,PA)是内囊体膜脂质合成的重要前体。PA主要在内质网合成,并被转运至叶绿体进一步加工合成糖脂(内囊体特有且重要的脂类)。然而,脂质从其它细胞器转运到叶绿体的分子基础仍有待进一步阐明。
Sec14蛋白具有Sec14结构域,是一类在所有真核生物中被鉴定的保守蛋白。在动物和酵母中的研究发现,Sec14蛋白可以结合和转运广泛的脂质,在胞内可以转运磷脂酰胆碱(PC)、磷脂酰肌醇(PI)和磷脂酰乙醇胺(PE)等脂质,然而对植物Sec14蛋白家族在脂质转运方面的研究目前仍较少。
2023年1月31日,上海交通大学农业与生物学院薛红卫课题组与苏州大学医学院吴嘉炜课题组合作在PNAS发表了题为Arabidopsis Sec14 proteins (SFH5 and SFH7) mediate inter-organelle transport of phosphatidic acid and regulate chloroplast development的研究论文,通过遗传学、结构生物学研究,阐明了PA由内质网转运至叶绿体的分子基础,及其调控类囊体糖脂合成的分子机制。

拟南芥Sec14蛋白家族成员AtSFH5和AtSFH7定位于内质网和叶绿体,功能研究表明其参与叶绿体发育的调控,sfh5 sfh7双突变体的叶绿素合成以及叶绿体内囊体结构出现异常。生化分析表明AtSFH5和AtSFH7与PA特异结合,进一步通过结构生物学对与L-α-磷脂酸(L-α-PA)复合物中的AtSFH5-Sec14结构域的晶体结构分析表明,PA分子的两条脂肪酰基结合在AtSFH5和AtSFH7的Sec14结构域的中心位置,并区别于动物/酵母Sec14蛋白结合PC/PE/PI的结合模式,解析了AtSFH5和AtSFH7特异性转运PA的结构基础。利用叶绿体开展的定量脂质组学分析表明,AtSFH5和AtSFH7缺失下PA和单半乳糖酰二酰基甘油(MGDG),特别是MGDG中sn-2位置的C18脂肪酰基显著减少,表明内质网到叶绿体的脂质转运异常,证明了AtSFH5和AtSFH7将PA从内质网转运至叶绿体进行糖脂合成的重要作用。
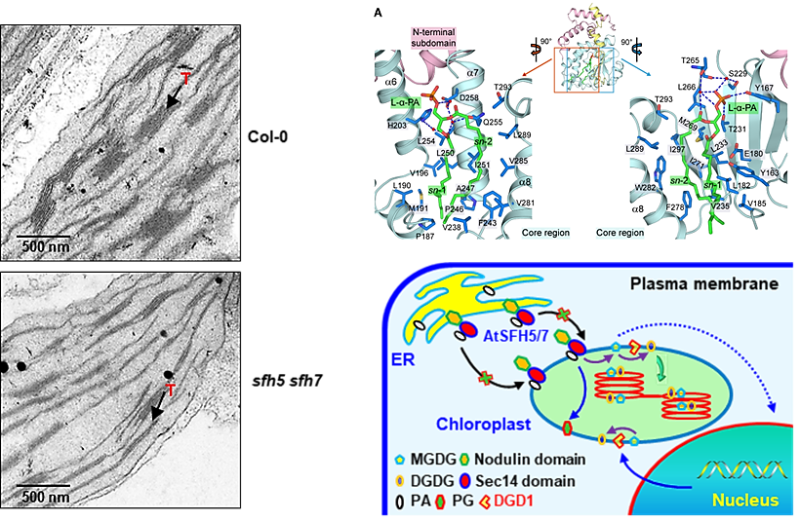
综上,该研究阐明了AtSFH5和AtSFH7通过胞内转运PA调控叶绿体内囊体结构/植物光合作用的分子机制,揭示了植物SFH蛋白在细胞器间PA转运中的作用并阐明了其结构基础,为细胞器间的脂质转运提供了一个分子模型,也为质体内共生进化理论提供了脂质信号交流的分子证据。
复旦大学生命科学学院姚红艳副研究员、苏州大学医学院鲁耀骐博士、中科院分子植物科学卓越创新中心杨晓莉博士为本文共同第一作者。上海交通大学薛红卫教授和苏州大学医学院吴嘉炜教授为共同通讯作者。苏州大学王晓清硕士生和罗智璞教授,上海交通大学林德立博士参与了研究工作。该研究得到了国家自然科学基金的资助。
论文链接:https://www.pnas.org/doi/10.1073/pnas.2221637120