
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交通大学医学院附属第九人民医院张志愿院士、何悦教授团队揭示m6A修饰在头颈鳞癌免疫微环境调控中的作用机制
N6-甲基腺苷(m6A)修饰是RNA上丰度最高的修饰方式,属于转录后调控的重要机制,在各种生理和病理条件下发挥着关键作用,也给疾病治疗提供了崭新的靶点。然而,m6A在头颈鳞癌中的修饰状态以及作用模式尚不清楚。2022年4月,张志愿院士/何悦教授团队在肿瘤学权威期刊《分子癌症》(IF=41)在线发表题为“The m6A demethylase ALKBH5 promotes tumor progression by inhibiting RIG-I expression and interferon alpha production through the IKKε/TBK1/IRF3 pathway in head and neck squamous cell carcinoma”的研究论文,该研究首先通过TCGA数据库全景分析了头颈鳞癌中所有m6A调节蛋白的表达谱,找出了丰度最高的差异蛋白-ALKBH5。并进一步通过研究展示了头颈鳞癌中m6A状态的下调和两种去甲基化酶的上调。体内、外实验发现沉默m6A去甲基化酶ALKBH5可以显著抑制肿瘤进展。m6A免疫沉淀测序结合转录本测序发现DDX58 mRNA是ALKBH5调控的靶点。ChIRP结合质谱鉴定出HNRNPC是DDX58 mRNA的m6A位点的读码蛋白,通过剪切促进其成熟。ALKBH5过表达通过关闭IKKε/TBK1/IRF3通路抑制DDX58编码蛋白RIG-I介导的干扰素α分泌。利用免疫健全鼠荷瘤模型发现ALKBH5通过抑制干扰素α分泌干预微环境中免疫杀伤细胞的浸润,为肿瘤细胞免疫逃逸提供了土壤。
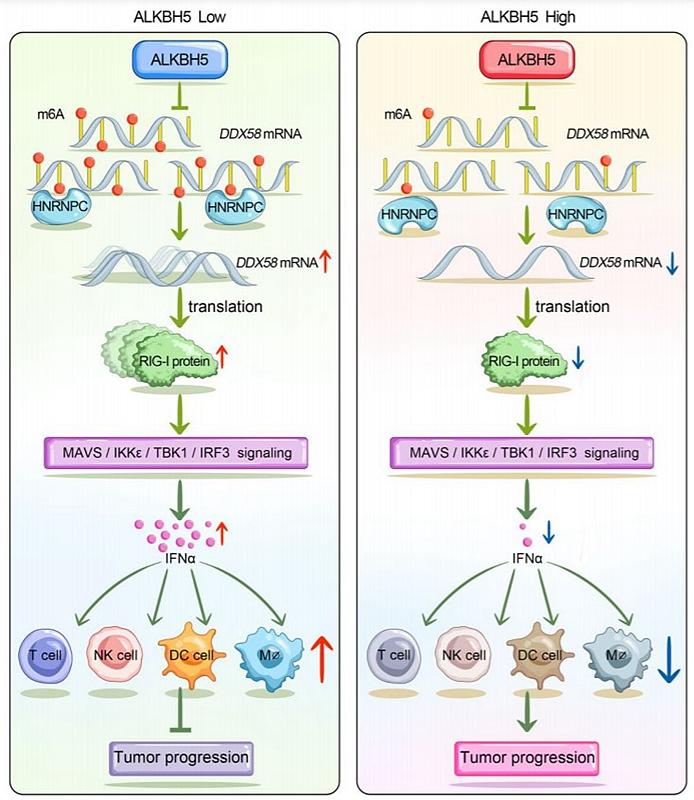
文章模式图(图源自Molecular Cancer)
N6-甲基腺苷(m6A)修饰是100多种真核mRNA修饰中最丰富的。它是一种动态RNA修饰,由“写入蛋白”METTL3、METTL14和WTAP添加,被“擦除蛋白”FTO和ALKBH5擦除,并被“识别蛋白”识别,例如YTH结构域家族成员(YTHDF1-3、YTHDC1/2)、IGF2BPs和异质核核糖核蛋白(HNRNP)家族成员。
越来越多的证据表明,m6A修饰在转录后水平调节RNA的稳定性、定位、输出、剪接和翻译,从而在细胞重编程、精子发生、T细胞稳态和内皮造血转化中发挥关键作用。m6A修饰的失调与胶质母细胞瘤、乳腺癌、胃癌、结直肠癌等癌的发生发展密切相关。然而,m6A介导的表观转录组的研究才刚刚开始,m6A修饰在肿瘤进展中的作用有待进一步研究。
头颈鳞癌严重破坏咀嚼、呼吸、吞咽等基本生理功能,甚至可能危及生命。综合治疗包括手术、放化疗和靶向治疗后,5年生存率为50-60%,迫切需要探索驱动头颈鳞癌进展的机制。m6A修饰的研究开启了转录后调控的新视角,而m6A的修饰状态以及它如何参与头颈鳞癌的进展在很大程度上是未知的。
干扰素α是第一个被发现的细胞因子,由大多数有核细胞产生,在免疫细胞分化和激活、抗原呈递、共刺激机制和免疫监视中起着不可或缺的作用。课题组前期发现干扰素α通过上调视黄酸诱导基因I(RIG-I)来增强靶向治疗的效果。RIG-I是一种关键的细胞溶质模式识别受体,对于检测病毒RNA和启动先天免疫反应至关重要。然而,干扰素α信号的过度激活通过上调程序性细胞死亡配体1来促进免疫抑制微环境的形成。由于干扰素α在头颈鳞癌治疗中是一把双刃剑,因此探索肿瘤微环境中干扰素α分泌的上游机制非常重要。
该研究针对上述问题,团队通过m6A测序、RNA转录测序、免疫沉淀质谱等多种技术手段,揭示了一种全新的由m6A修饰通过ALKBH5/RIG-I/IFNα轴介导的免疫微环境调控新机制,一方面拓展了对免疫微环境调控的理解,另一方面为重塑肿瘤微环境提供了新的思路。
该研究在上海交通大学医学院附属第九人民医院张志愿院士的指导下完成,口腔颌面头颈肿瘤科何悦教授、张建军研究员、马海龙医师(博士导师为张志愿院士)为通讯作者,金淑芳主治医师(博士导师为何悦教授,博士后导师张志愿院士)为第一作者。相关工作得到国家自然科学基金、中国科协青年托举人才计划、上海市科技启明星、上海市“医苑新星”、上海市自然科学基金和中国博士后科学基金等项目的资助。