
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大邓子新团队合作揭示超级抗生素darobactin的生物合成机制
近日,上海交通大学生命科学技术学院、微生物代谢国家重点实验室邓子新教授团队在《Nature Communications》合作发表了题为“Radical SAM-dependent ether crosslink in daropeptide biosynthesis”的研究论文,首次揭示了超级抗生素darobactin的双环形成机制。生命科学技术学院硕士研究生郭思佳和复旦大学博士后王舒为论文并列第一作者,生命科学技术学院丁伟副教授和复旦大学张琪教授为论文通讯作者。
由于革兰氏阴性菌特殊的荚膜结构,其对大部分抗生素都具有抗性。开发和研究新型革兰氏阴性菌抗生素对于未来人类的生活和健康具有重大的意义。Darobactin是2019年从嗜线虫发光杆菌的代谢产物中发现的一种新型核糖体肽(RiPP),其对于多种革兰氏阴性菌具有优良的抗菌活性,是自上世纪60年以来发现的第一个具有新骨架的革兰氏阴性菌抗生素。Darobactin含有一个罕见的醚键-碳碳键双环交联结构,能以高亲和力靶向结合细菌外膜BamA蛋白,抑制外膜蛋白的装配。Darobactin的生物合成基因簇含有5个基因:darA编码前体肽,darE编码SAM自由基酶DarE,darBCD编码ABC型转运蛋白。本研究通过一系列体内和体外反应,首次揭示了单独的SAM自由基酶DarE能够催化前体肽DarA 核心区氨基酸W1和W3之间形成C-O-C键、K5与W3之间形成C-C键,形成分子中的特征的双环结构。
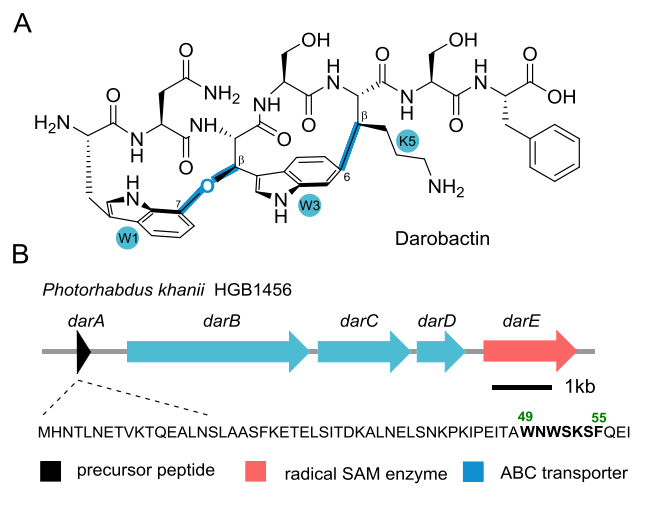
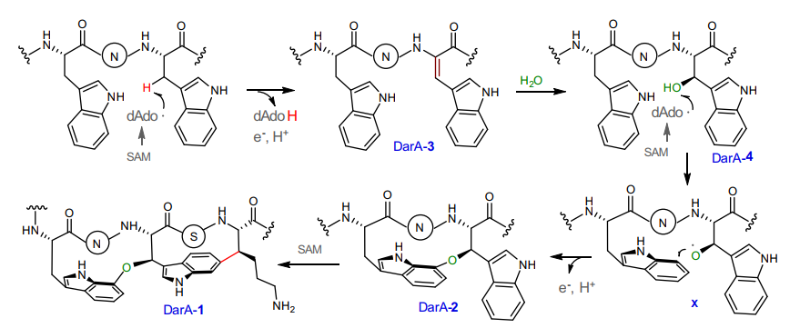
通过进一步细致的研究,作者证实了DarE通过一个全新的SAM自由基酶机制,将水分子的氧原子插入到两个色氨酸之间,形成其关键的醚键交联。作者同时也证实双环的形成是分步的,当醚键交联形成之后再实现C-C键的交联。进一步的基因组挖掘和异源表达研究证实,自然界中存在多类darobactin的结构类似物(daropeptide),部分天然产物仅具有单醚键环结构。本研究揭示了SAM自由基酶DarE全新的功能和催化机制,为核糖体肽类阴性菌抗生素的深度挖掘和合成生物学研究奠定了坚实的基础。
该工作得到了国家重点研发计划、自然科学基金等项目的资助。
原文链接:https://www.nature.com/articles/s41467-022-30084-2