
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大朱建伟教授团队研发新的靶向实体瘤的T细胞免疫疗法
在肿瘤治疗中,T细胞依赖型双特异性抗体(T cell engaging bispecific antibody,TCB)是T细胞免疫疗法的重要组成部分。目前在临床上,TCB已在血液瘤中显示了较好的治疗效果。然而在实体瘤中,实体瘤促结蹄组织增生的基质和免疫抑制性微环境降低了TCB的活性,目前只有少数TCBs显示了早期临床疗效。为了进一步探索TCB对实体瘤的治疗潜力,需要开发更多的靶向新的抗原、新的表位或使用新结构的TCBs以及探索可能的联合用药。
上海交大药学院、细胞工程及抗体药物教育部工程研究中心朱建伟教授团队一直致力于靶向实体瘤的TCB研发。在近几年的研究中,发明了具有自主知识产权的双特异抗体组装方法“Bispecific Antibody by Protein Trans-splicing” (BAPTS),并获得中国和国际专利授权。在这个创新的平台上,朱建伟教授团队筛选、设计、和评价了多个靶向不同肿瘤相关抗原(PRLR、VEGFRvIII、Lewis Y及Tissue Factor)的TCBs,从2020年底至今连续发表了四篇中科院一区论文,成为在这一领域中有影响的研究中心。本月在药学领域顶级期刊Acta Pharmaceutica Sinica B上发表的有关靶向组织因子(tissue factor,TF)的TCB的研究发现靶向TF的TCB相较于靶向其它抗原的TCBs具有更强的T细胞激活和肿瘤细胞杀伤活性。在该研究中通过体内外多种模型首次验证了靶向TF的TCB治疗实体瘤的可行性。所设计的TF-TCB制备工艺简单,肿瘤抑制活性强,具有一定的临床开发潜能。此外,该研究在靶点,TCB结构以及联合用药方面的探索也为实体瘤治疗中TCB的开发提供参考。
该研究首先对TF在肿瘤组织和正常组织上的表达进行了评价,补充和完善了TF的表达谱。研究结果表明超过40%的肺鳞状细胞癌,结肠腺癌,前列腺腺癌和胰腺导管腺癌组织高表达TF。TF在一些正常组织上也有所表达,但相较于肿瘤组织,其在大多数正常组织上表达量较低。

图1 TF-TCB结构的示意图
研究小组设计的TF-TCB采用了IgG-[L]-scFv型对称结构,减少了双特异性抗体生产过程中的链错配问题(图1)。研究表明TF-TCB可以通过与普通IgG类似的方式被制备,制备工艺简单,一步Protein A亲和层析纯化后纯度可达95%以上。TF-TCB体外显示了较好的构象稳定性和储存稳定性,具有较好的成药性。
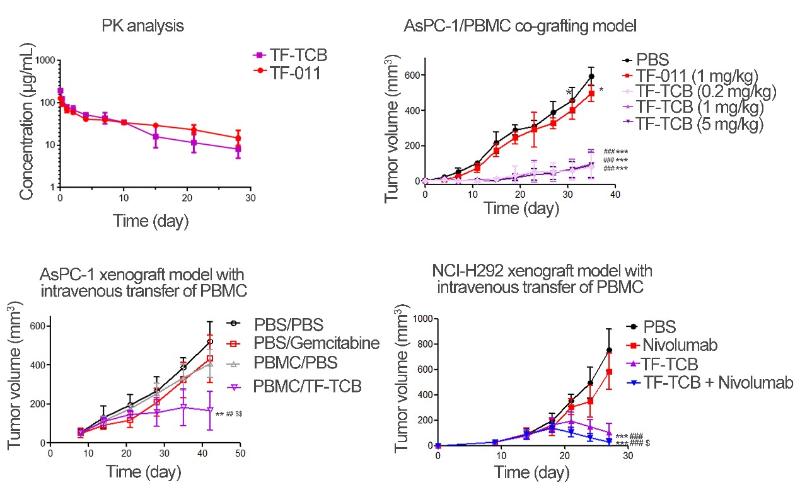
图2 TF-TCB的体内活性评价
在论文中,通过体外体内多种模型评价了TF-TCB的生物活性。TF-TCB在体外可以交联TF阳性细胞和CD3阳性细胞,并靶点依赖性的介导T细胞激活、肿瘤细胞裂解以及随后的T细胞增殖。TF-TCB活性的靶点依赖性降低了TCB可能的脱靶毒性。在小鼠体内,TF-TCB具有较好的药代动力学特征,半衰期约为8天(图2)。在肿瘤细胞/PBMC混接模型和低T细胞浸润的肿瘤-PBMC尾静脉输入模型中,TF-TCB均能有效抑制肿瘤的生长,引起肿瘤的消退(图2)。通过免疫组织化学分析,证明了TF-TCB是通过募集T细胞到肿瘤和对肿瘤细胞的杀伤来抑制肿瘤生长。此外,研究发现TF-TCB和T细胞以及肿瘤细胞的共孵育可以提高T细胞上PD-1和肿瘤细胞上PD-L1的表达水平。通过体内外评价TF-TCB和PD-1抗体Nivolumab的联合用药,该研究证明可通过与免疫检查点抑制剂联合使用来进一步提高TF-TCB的活性。
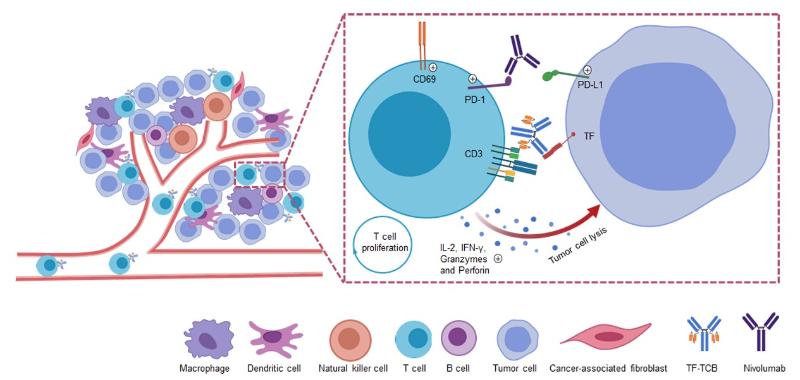
图3 TF-TCB的作用机制
综上,在靶向实体瘤的TCB研发中,朱建伟教授团队首次设计和表征了靶向TF的TCB,并证明了TF可作为TCB的靶点用于实体瘤的治疗。最终获得的TF-TCB在体内外多种模型中显示了较好的抗肿瘤活性,具有一定的临床开发潜力。
该研究的通讯作者是上海交通大学药学院朱建伟教授,第一作者是上海交通大学药学院博士研究生潘芝弟。
论文链接:https://www.sciencedirect.com/science/article/pii/S2211383521004317