
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大基础医学院朱亮课题组揭示克服肺癌EGFR靶向治疗耐药新机制
肺癌是包括我国在内的多个国家致死人数最多的恶性肿瘤,其EGFR-TKI靶向治疗效果显著,是精准医学的典范。然而,无论是第一、二代,还是第三代新型药物,初治显效后均几乎不可避免出现耐药,极大限制了该类药物最终临床疗效的发挥,是临床治疗的严峻挑战。目前发现的耐药机制,解释了部分遗传学耐药原因,但涉及层面有限,其他维度的机制还存在诸多未解之谜;对第三代抑制剂耐药机制的了解,则更为匮乏,即使发现的部分耐药原因,也缺乏针对性药物上市予以克服,一旦出现耐药则应对手段极为有限。揭示耐药新机制、寻找克服耐药新靶点,是肿瘤科学领域的前沿问题,也是研发克服耐药新型药物的前提,具有重要的科学价值和临床转化意义。
10月7日,上海交通大学医学院药理学与化学生物学系朱亮课题组在Science Translational Medicine期刊在线发表题为“Targeting AKR1B1 inhibits glutathione de novo synthesis to overcome acquired resistance to EGFR- targeted therapy in lung cancer”的研究成果,揭示肺癌EGFR-TKI耐药新机制并提示克服耐药新治疗手段。
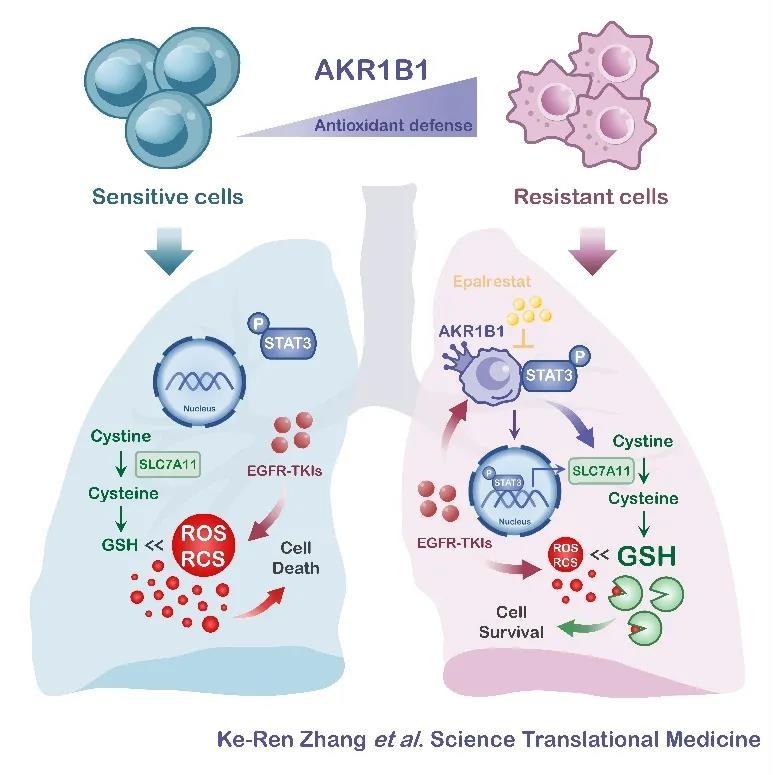
课题组基于前期研究结果,结合转录组学分析,在符合临床治疗路径的体内体外耐药模型及临床耐药复发数据库中筛选出与耐药相关的蛋白分子AKR1B1,功能性研究发现对一代和三代EGFR-TKI耐药的多种肿瘤细胞模型,其存活、生长和药物抵抗均依赖于AKR1B1,反之,原先对EGFR-TKI敏感的肿瘤细胞,若高表达该分子,则在体外和体内均获得耐药能力。
基因组和代谢组学整合分析表明耐药细胞普遍发生代谢重组现象,非靶向代谢组学检测提示其中谷胱甘肽代谢途径最为显著,随后的靶向代谢组学分析发现谷胱甘肽从头合成代谢通路在耐药细胞更为活跃,同时,耐药复发肿瘤病人血液中、耐药复发小鼠肿瘤组织和血液中还原性和氧化型谷胱甘肽也更为富集。同位素示踪代谢流分析显示耐药细胞对环境中胱氨酸的摄取能力以及随后由胱氨酸流向谷胱甘肽从头合成代谢的能力增强。该代谢机制将耐药细胞中活性氧ROS和活性羰基化合物RCS维持在较低水平,并决定耐药细胞对EGFR-TKI的抵抗能力。以乙酰半胱氨酸(NAC)喂饲的小鼠,其肿瘤对多种EGFR-TKI耐药,停止NAC喂饲后该耐药特性消退。耐药细胞增强的胱氨酸摄入和谷胱甘肽从头合成由受AKR1B1调控,用遗传学或药理学手段抑制AKR1B1可取消上述代谢特征并且逆转耐药,反之若敏感细胞高表达AKR1B1则使谷胱甘肽从头合成增强并获得耐药性。
进一步研究表明AKR1B1与转录因子STAT3相互作用,使后者激活,进入细胞核,增加靶基因SLC7A11转录。SLC7A11的蛋白产物细胞膜胱氨酸转运体上调后使细胞胱氨酸摄入增加,加强谷胱甘肽从头合成,淬灭ROS和RCS,提高肿瘤细胞应对药物压力的能力,从而产生耐药(图1)。
鉴于AKR1B1对耐药的驱动和维持作用,课题组应用其已上市用于治疗糖尿病神经病变的选择性抑制剂依帕司他予以适应症重定位策略靶向干预,可使耐药细胞重新获得对一、三代EGFR-TKI的敏感性,并且在负荷人源肿瘤细胞系来源移植瘤(CDX)和人源肿瘤组织来源移植瘤(PDX)的小鼠体内阻止耐药的产生。
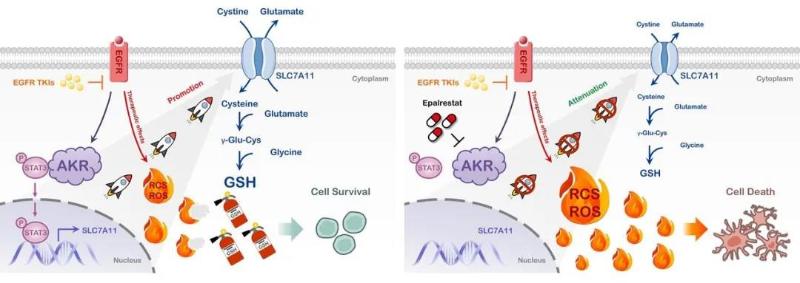
肺癌EGFR-TKI耐药的AKR依赖性代谢重编程机制及其逆转策略
该研究从代谢维度发现肺癌EGFR靶向治疗耐药的新机制,同时也提示实体瘤靶向药耐药存在代谢重编程驱动因素。所发现的AKR关键节点是EGFR-TKI多代靶向药共有新机制,药理学干预后在临床前实验中显示预防及克服耐药作用,甚至对棘手的第三代药物奥希替尼耐药亦有效。Science Translational Medicine同期配发编者按,提示该研究对克服肺癌EGFR靶向药耐药治疗策略的启示作用。
课题组19级博士生张可人、17级硕士生张雨霏,雷绘敏硕士、唐亚斌博士为共同第一作者,朱亮教授、陈红专教授和沈瑛研究员为共同通讯作者。研究得到国家自然科学基金委员会和上海市科委课题资助,并获上海市转化医学协同创新中心大力支持。相应药物新用途已申报国家发明专利(申请号:202010498449.0)。
论文链接:https://www.science.org/doi/10.1126/scitranslmed.abg6428
