
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大生科院赵一雷团队通过理论计算揭示XimE环化酶催化的二分特性
近日,美国化学会催化领域顶级期刊《ACS Catalysis》在线刊发了上海交通大学生命科学技术学院、微生物代谢国家重点实验室教授赵一雷团队在酶催化分子机制研究上的最新进展,“Computational Exploration of How Enzyme XimE Converts Natural S-Epoxide to Pyran and R-Epoxide to Furan”。该工作阐明了厦门霉素生物合成途径中XimE环化酶的独特催化机制,揭示了两种相反手性的环氧化底物在酶催化下分别合成苯并杂环衍生物呋喃香豆素和吡喃香豆素两种不同环化产物的微观过程,这种二分杂合特性填补了酶分子生物进化过程特异性转化的关键一环。
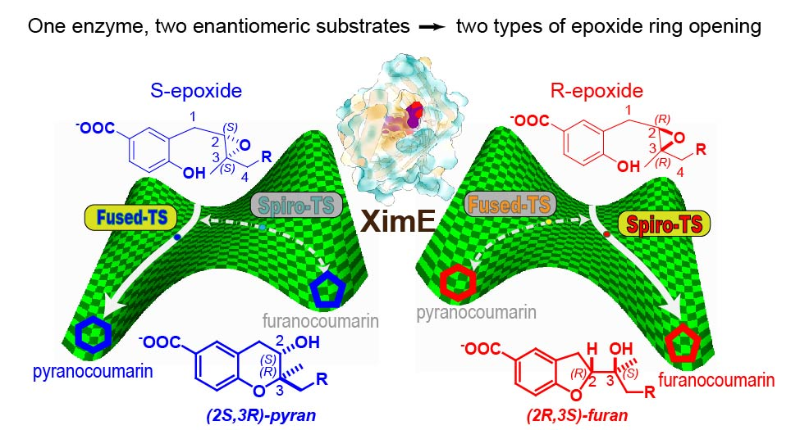
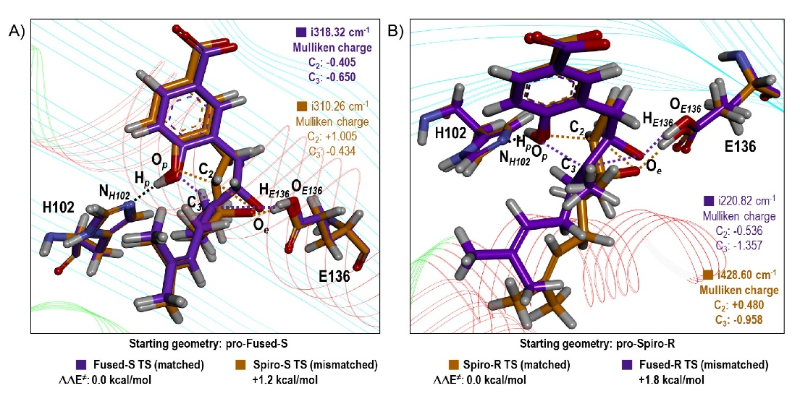
长期以来,特异性和效率被认为是生物催化剂酶的一个重要特征。然而,最初在厦门霉素生物合成中发现的类SnoaL环化酶(XimE)不仅能够催化上游基因XimD产生的天然环氧化物代谢物的吡喃环化反应,而且可以增强非天然环氧化物异构体的呋喃环化反应。课题组通过理论酶簇模型、预反应态和后反应态MD模拟、ONIOM过渡态计算和QM/SCRF(VS)介电常数扫描阐明了XimE中独特的底物控制酶功能的反应机制。两条催化途径具有类似的广义酸碱催化机制,皆由E136和H102分别充当质子供体和受体,融合型过渡态合成吡喃产物而螺型过渡态则合成呋喃产物。其催化的区域选择性源自酶与两种过渡态之间的诱导契合作用,这种底物-酶的相互作用可以延续到酶-产物复合物中,控制了不同产物的催化效率。XimE显然与上游XimD环氧化物酶产生的天然S-环氧化物底物一起进化,偶然地通过相近的广义酸碱催化机制催化对映体R-环氧化物的另一类环化反应。
高立体选择性的环氧开环反应在聚醚类生物药物合成中具有特殊意义,也是最早人工抗体酶的目标反应之一,XimE环化酶的研究结果阐明了长期以来广为争论的鲍德温关环规则(Baldwin’s Rule)在生物合成中环氧丙烷开环反应中出现的例外现象。
上海交大生命科学技术学院硕士生蒋础础、贺贝贝分别为第一和第二作者,教授徐岷涓、赵一雷和美国加州大学洛杉矶大学教授Houk为共同通讯作者,上海交通大学生命科学技术学院为第一署名单位/通讯单位。该工作得到了国家重点研发计划、自然科学基金面上项目、教育部代谢与发育科学国际合作联合实验室的资助。
论文链接:https://pubs.acs.org/doi/abs/10.1021/acscatal.1c01335