
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大系统生物医学研究院在转录因子调控原钙粘蛋白三维基因组机制研究中取得重要进展
北京时间4月14日,牛津大学出版社出版的、国际权威学术期刊《核酸研究》在线发表了上海交通大学系统生物医学研究院比较生物医学中心教授吴强团队以“Mechanism of REST/NRSF Regulation of Clustered Protocadherin Alpha Genes”为题目的最新成果,揭示了转录因子REST结合DNA模式和调控原钙粘蛋白表达的重要机制。
在大脑发育过程中,人类860亿个神经元必须通过数万亿突触进行连接,形成复杂的神经网络,来完成准确的信号传递和感觉运动、认知信息的有效处理。大脑神经网络建立的失败或异常会导致神经发育和神经精神障碍。为了形成合适的突触连接,神经元进化出了自我回避机制来区分各自的独特性,以最大限度地形成功能性突触连接。脊椎动物和无脊椎动物的神经自我回避都需要细胞表面识别分子的独特组合表达来产生单个细胞表面的分子识别代码。在哺乳动物中,原钙粘蛋白家族的约60个基因的随机选择性表达产生的分子多样性,就为大脑中单个神经元提供了自我回避所需的细胞特异性。原钙粘蛋白是如何选择性地抑制部分成员而让其他成员表达的分子机制尚未被完全阐明。
神经元特性的有序获得及维持需要下调转录抑制因子来解除神经特异性基因的抑制状态。抑制元件的沉默转录因子REST或者叫神经元限制性沉默因子,就是一个重要的神经基因的抑制因子,它能抑制神经前体细胞和非神经细胞中大量神经特异性基因的表达。REST是一个含有串联排列锌指结构域的锌指蛋白,通过串联排列的锌指结构域与人类基因组中成千上万的位点结合后,抑制相应基因的表达,REST是怎样识别人类基因组中成千上万的位点这一核心问题一直没有得到解决。
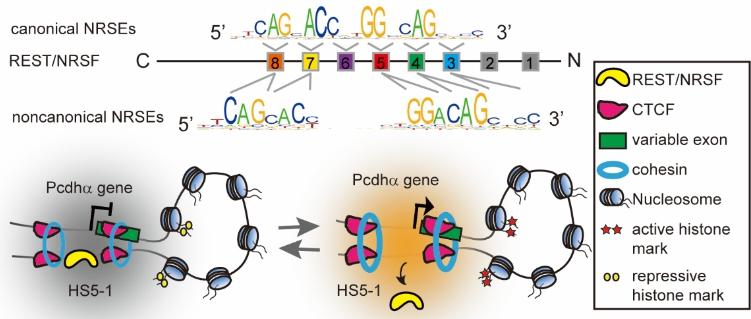
吴强团队致力于原钙粘蛋白三维基因组表达调控的分子机制研究。在此研究中,该团队鉴定出原钙粘蛋白超级增强子和可变外显子中的REST结合位点的图谱。该研究通过一系列实验发现REST通过其串联排列锌指结构域,以碱基特异性反向平行的方式识别人类基因组中成千上万的位点,这种方向性的结合对于REST调控神经系统基因表达至关重要,进一步研究发现REST通过构象转换的方式来识别人类基因组中不同类型的结合位点,解开了人类基因组为什么具有不同类型的REST位点这个长久的未解之谜。人类基因组中有800多种转录锌指蛋白的基因,本研究的发现对于阐明锌指结构转录因子识别和构建人类基因组的机制具有重要意义。
最后,该团队通过自主开发的DNA片段编辑技术,首次发现REST能够抑制超级增强子和靶向启动子之间的远距离相互作用,这种三维基因组染色质高级结构的改变,伴随着染色质表观遗传学修饰的改变,以及染色体架构蛋白CTCF富集的增加和DNA甲基化的降低,即REST通过方向性基因组结合后,借助CTCF介导的增强子和启动子间的特异性相互作用和染色质表观遗传学修饰来改变三维基因组染色质高级结构,远距离地抑制神经基因的表达。与传统的启动子附近REST结合位点抑制近距离基因表达的调控机制相比,这个发现是个全新的机制,且为全面研究神经基因是在组织器官发育中是抑制机制奠定了基础。该研究得到了三位专家评审的高度肯定并迅速被《核酸研究》杂志接收。
该研究由上海交通大学系统生物医学研究院吴强课题组和达林泰课题组合作完成,吴强为通讯作者,交大博士生汤元霄为第一作者。该研究得到了国家自然科学基金、科技部和上海市科委的资助。
论文链接: https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab248/6225233