
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大电院团队最新研究成果助力新冠肺炎药物研制
近日,电子信息与电气工程学院团队在权威期刊Briefings in Bioinformatics上(IF=8.99, JCR 1区top期刊),发表新冠肺炎最新研究成果,该成果将为后续药物研究,提供基础,助力新冠肺炎特效药的研制。
2020年初新型冠状病毒(COVID-19)爆发以来,大量科研人员和医药工作者开始紧急研发有效抗病毒药物和疫苗。但是治疗新冠肺炎的特效药无法短期被研发出来。研究人员一直尝试从大量临床药物数据库中筛选出能够抑制新型冠状病毒的药物。国家科技部早在2月中旬就选定了100种左右的临床药物在动物体内开展抗新型冠状病毒的实验,志在实现老药新用。

自2020年2月底,上海交通大学电院李金金团队开始针对新型冠状病毒抑制剂进行深入的理论研究,近日最新研究成果(Potential Inhibitors for the Novel Coronavirus (SARS-CoV-2))于2020年9月18日发表在计算机与生物信息学交叉领域权威期刊《Briefings in Bioinformatics》(IF=8.99, JCR 1区top期刊)上。

这篇文章从药物数据库中虚拟筛选出7种潜在的能够抑制新型冠状病毒的临床药物,包括治疗和预防疟疾的氯喹(Chloroquine)及其衍生物羟氯喹(Hydroxychloroquine),病毒蛋白酶抑制剂茚地那韦(Indinavir)、利托那韦(Ritonavir),瑞德西韦(Remdesivir)、法维拉韦(Favipiravir)和Beclabuvir。通过蛋白质-配体分子对接技术和分子动力学方法理论模拟药物分子和病毒蛋白质的结合作用过程,研究临床药物与病毒蛋白质(3CL水解酶,3CL Mpro)的结合机制和抑制能力。4月份Science杂志上发表了一系列人工设计的抑制新冠病毒的药物分子,其中一种α-酮酰胺抑制剂(13b)可能存在比较强的抑制能力。李金金团队随后开展了针对13b以及其他临床药物与新型冠状病毒结合能力机制的研究。

病毒蛋白和13b分子对接可视化
(a)病毒蛋白和13b分子对接后的solid-surface模型
(b)病毒蛋白和13b分子对接位点的球棍模型及相互作用最强的5个残基
结果表明,研究的临床药物中氯喹与病毒蛋白质的结合能力最强,说明氯喹对新型冠状病毒的抑制能力在‘老药’中是最强的,是临床药物中最可能进一步推广使用的药物,可实现老药新用。此外,研究结果还最终确认了人工设计的α-酮酰胺抑制剂(13b)与病毒蛋白质的结合能力要明显强于之前所研究的所有临床药物,非常有希望开展后续临床实验,取代目前的治疗药物,成为治疗新冠肺炎更加有效的药物。
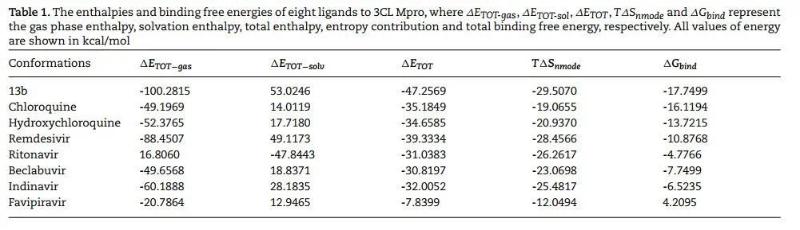
MMPBSA计算得到的α-酮酰胺13b及7种临床药物与新型冠状病毒蛋白的结合能
该文章还详细研究了药物分子和新型冠状病毒蛋白的结合作用机制,通过分子对接手段确定了不同药物分子与病毒蛋白结合的位点信息,以及蛋白质残基对结合能力的贡献程度。研究的8种抑制剂分子都会倾向于与病毒蛋白结合在相近的位点。对于结合能力最强的13b分子,病毒蛋白残基MET165和HIE163对于药物与病毒结合的贡献最大,其中残基MET165贡献主要是范德华相互作用,HIE163主要贡献是静电能。文章所研究的药物分子和3CL水解酶的结合机制以及残基对结合能的贡献分析可以为后续药物研究提供理论基础,并指导新冠病毒抑制剂的设计,研制出针对新冠肺炎治疗效果更好的药物。
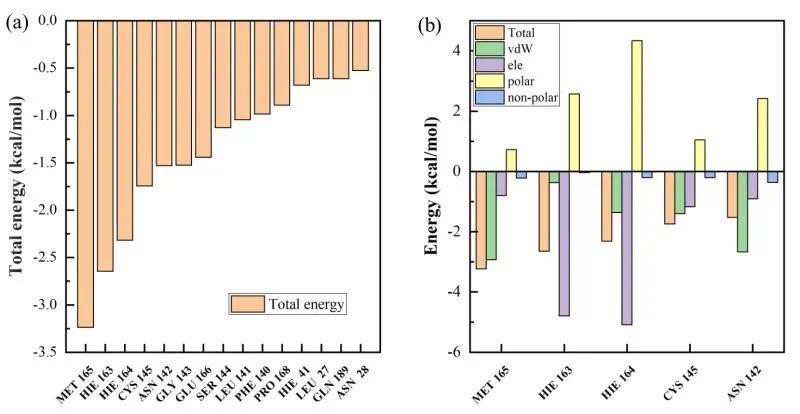
结合自由能中蛋白质关键残基的相互作用分析
(a)病毒蛋白和13b分子结合贡献最高的残基
(b)贡献最高的5个残基作用力分解
上海交通大学电子信息与电气工程学院微纳电子学系博士生韩彦强为本论文第一作者,微纳电子学系李金金特别研究员和同济大学医学院副研究员魏之昀为共同通讯作者。该研究工作得到了国家自然科学基金、上海交通大学等的支持。