
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交通大学系统生物医学研究院张冰课题组发现新的DNA修复通路
2020年7月28日,上海交大系统生物医学研究院张冰课题组在国际权威期刊《Cell Reports》上,发表了题为《LARP7 is a BRCA1 ubiquitinase substrate and regulates genome stability and tumorigenesis》的研究论文。上海交通大学张冰研究员为本文通讯作者,上海交通大学张芳,博士生闫鹏一,于蕙菁以及副研究员乐黄莺为本文的共同第一作者。

当细胞遭受紫外线,离子辐射或代谢产生的活性氧等因素导致DNA损伤时,会立即启动DNA损伤响应机制(DNA damage response, DDR)进行DNA 修复。DDR缺陷会导致损伤DNA的不断累积,造成基因组的不稳定性并促进肿瘤的发生。因此阐释DDR及DNA 修复机制,对于肿瘤诊断和治疗具有重要意义。
BRCA1是著名的肿瘤抑制基因, 在3%-18% 的所有乳腺癌和宫颈癌病人以及45%遗传性乳腺癌和宫颈癌病人中都发现有BRCA1的突变。研究证明BRCA1突变是早发型乳腺癌和宫颈癌的主要致病机制。BRCA1 突变的基因检测已成为目前乳腺癌和宫颈癌的临床诊断的重要指标。已有研究发现BRCA1主要通过调控G2/M细胞周期检验点,增强同源重组修复(HR)以及控制异染色质转录等抑制肿瘤发生。除此之外,BRCA1 E3泛素连接酶活性在DNA修复以及肿瘤抑制过程中也发挥重要作用。在大量临床乳腺癌和宫颈癌样本中也发现了影响BRCA1 E3泛素连接酶活性的突变位点。但是BRCA1及其核心复合物BARD1的泛素化底物尚不清楚,其参与调控DNA损伤修复的机制也有待研究。
本研究工作的一个重要进展是首次鉴定出RNA结合蛋白LARP7是BRCA1/BARD1的泛素酶的底物。 X射线及一线化疗药顺铂可以通过激活DDR 通路关键蛋白ATM 来磷酸化LARP7蛋白, 进而招募BRCA1/BARD1 泛素化LARP7,使其转运出核进入26S蛋白酶体降解途径。降解的LARP7抑制CDK1/CCNB1/CCNB2的表达, 激活G2/M 检验点,导致细胞周期的阻滞。同时CDK1/CCNB1/CCNB2表达降低还抑制BRCA2在S3291位点的 磷酸化水平,促进同源重组修复蛋白RAD51招募到损伤DNA,从而促进基因组DNA的同源修复过程。
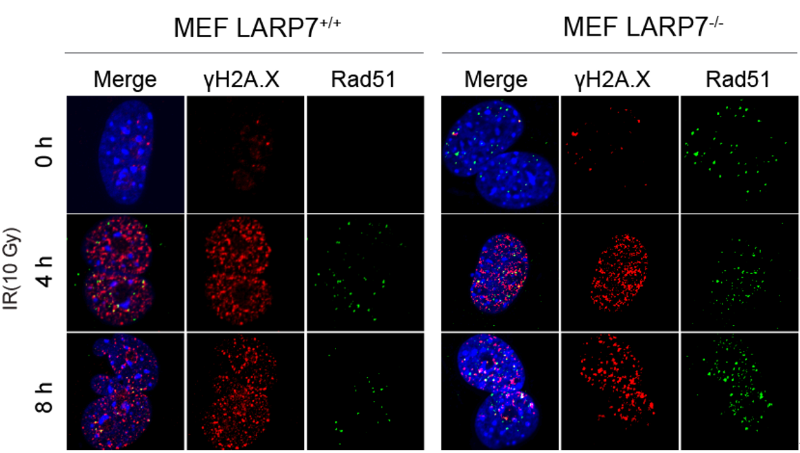
在MEF细胞中敲除LARP7促进了RAD51招募和DNA修复
该工作还进一步探索LARP7在肿瘤治疗中的潜在应用价值。通过分析了210例乳腺癌病人样本,发现LARP7在乳腺癌细胞中高表达,并与肿瘤恶性程度呈正相关。同时在人群研究中发现,LARP7降低增加了病人对放化疗的抵抗,并在乳腺癌移植瘤裸鼠的放疗(X射线)和化疗(顺铂)模型中进行了验证。相反,提高LARP7则可以显著提高病人对放化疗的敏感性。
综上,该项工作首次发现了LARP7是BRCA1/BARD1 E3泛素连接酶的泛素化底物;阐明了ATM-BRCA1-LARP7-CDK1是一个新的的DDR通路;首次证明LARP7可以显著提高放疗与化疗的治疗效果, 有望成为癌症诊断和治疗的新靶点。