
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大系统生物医学研究院达林泰课题组和张延课题组在《ACS Catalysis》联合发表最新研究成果
近日,上海交通大学系统生物医学研究院达林泰课题组和张延课题组在生物化学领域著名期刊《ACS Catalysis》联合发表了题为 “Regulatory Role of One Critical Catalytic Loop of Polypeptide N-Acetyl Galactosaminyltransferase-2 in Substrate Binding and Catalysis during Mucin-Type O-Glycosylation”的最新研究成果。该研究运用计算化学和生物化学的方法从原子水平揭示了ppGalNAc-T2酶中一个关键结构域catalytic loop的构象变化过程及其对底物识别和酶催化反应的分子作用机制。
O-GalNAc糖基化是具有重要生物学功能的翻译后修饰类型。近年来,许多研究表明蛋白质特异性位点的O-GalNAc糖基化与肿瘤、神经退行性疾病等多种严重威胁人类健康的疾病密切相关。ppGalNAc-T酶是O-GalNAc糖基化修饰的起始糖基转移酶,在人体中,其家族有20个成员。ppGalNAc-T酶通过对底物位点的选择性催化,精密调控蛋白的O-GalNAc糖基化。已有研究报道,ppGalNAc-T酶催化结构域的catalytic loop在整个催化反应中至关重要。然而,现有的研究仍然缺少对 catalytic loop在原子水平上的理解。本研究以ppGalNAc-T2酶为例,通过分子动力学模拟以及构建马尔科夫模型的方法从原子水平揭示了catalytic loop的动态变化过程, 并捕捉到3个关键的构象变化中间态。另外,本研究发现,活性位点附近的若干氨基酸残基对调控catalytic loop的动力学过程起到关键作用,进而影响后续的底物识别。更进一步,结合计算的研究结果,我们对若干氨基酸位点进行了突变实验,并测定了它们的酶动力学、亲和力参数及糖基化位点。本研究揭示了catalytic loop在底物识别和糖基化位点选择性上的关键作用。
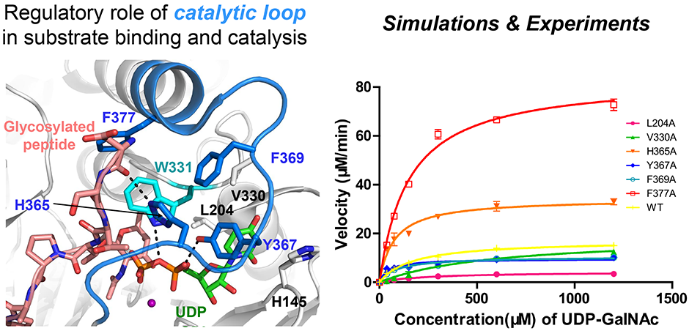
上海交通大学系统生物医学研究院达林泰课题组博士生田佳琪及张延课题组刘峰博士为本文共同第一作者。达林泰研究员与张延教授为该论文的共同通讯作者。
该工作得到了国家自然科学基金(31570796,31770850,21703139)的资助。
原文链接:https://doi.org/10.1021/acscatal.9b03782