
 探索发现 · 交大智慧
探索发现 · 交大智慧
附属九院精准医学研究院雷鸣团队揭示哺乳动物减数分裂前期端粒在核膜附着的结构基础
2019年2月4日,上海交通大学医学院附属第九人民医院精准医学研究院雷鸣课题组在国际学术期刊Nature Communicaitons杂志上发表了题为“The meiotic TERB1-TERB2-MAJIN complex tethers telomeres to the nuclear envelope”的研究工作,揭示了端粒通过减数分裂特异性TERB1-TERB2-MAJIN复合物结合到核膜进而调控同源染色体配对的结构基础和分子机制。
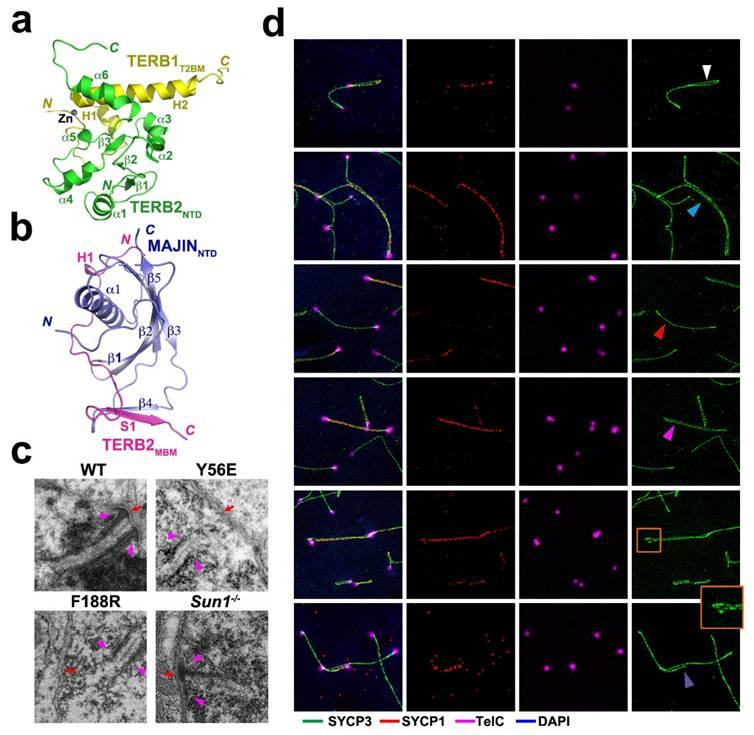
TERB1-TERB2-MAJIN介导端粒在核膜的附着。(a)TERB1-TERB2相互作用的晶体结构;(b)TERB2-MAJIN相互作用的晶体结构;(c)电镜显示不同基因型精母细胞端粒与核膜的结合情况;(d)IF-FISH显示Terb2突变导致联会的异常。
端粒是真核生物线性染色体的末端,由特定的DNA重复序列和蛋白质复合物组成,保护着基因组的完整性和稳定性。在减数分裂前期I的早期,端粒结合到跨核膜LINC复合体SUN1亚基的核内部位,在LINC复合体的介导下沿着核膜运动,并在短暂的时期内聚集在一起形成花束结构(bouquet);这一现象在减数分裂过程中非常保守,对同源染色体的正确配对和分离至关重要。在哺乳动物中,端粒和LINC复合体结合的分子机制仍然不清楚;此外,除了SUN1,内核膜上的MAJIN蛋白也能提供端粒在核膜的附着位点,但是其具体功能及发挥功能的结构基础和分子机制并不清楚。
雷鸣课题组之前报道了端粒蛋白质TRF1和其结合蛋白TERB1相互作用的结构基础(Long et al, NSMB,2017);最近又成功地解析了TERB1-TERB2与TERB2-MAJIN两个相互作用复合物的晶体结构,首次在原子水平上确定了从端粒到核膜的一条物理链接。进一步,研究人员从结构信息出发,构建了特异性破坏TERB1-TERB2或TERB2-MAJIN相互作用的两个Terb2突变体小鼠模型。研究显示,两个Terb2突变体小鼠模型表现出一致的减数分裂过程的缺陷,包括完全破坏端粒与LINC复合物的结合、损伤同源染色体配对的效率和准确率,从而造成联会的异常和减数分裂过程的停滞,并最终导致雄性与雌性小鼠的不育。该项研究阐明了端粒通过TERB1-TERB2-MAJIN复合物附着在核膜的结构基础,证实了端粒的核膜附着和端粒与LINC复合物的结合是两个分开调控的步骤,揭示了MAJIN介导的端粒-核膜附着对减数分裂同源染色体配对的重要功能。
雷鸣课题组的王妍博士和陈艳艳博士研究生为该论文的共同第一作者;雷鸣研究员、黄晨辉副研究员为该论文的共同通讯作者。该研究受到国家自然科学基金项目,中科院战略性先导项目(B类)和上海科学技术委员会项目资助。
论文链接:https://www.nature.com/articles/s41467-019-08437-1