
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大课题组发表核酸和化疗药物共递送系统最新成果
近日,上海交通大学基础医学院药理学与化学生物学系方超课题组在国际著名杂志《先进功能材料》(Advanced Functional Materials,影响因子12.124)在线发表了题为《整合型“智能”纳米系统共递送化疗药物和MicroRNA联合治疗原位结肠肿瘤》(Integrated Combination Treatment Using a “Smart” Chemotherapy and MicroRNA Delivery System Improves Outcomes in an Orthotopic Colorectal Cancer)的论文,据悉该文也即将于7月中作为封面论文正式发表。该研究创新性设计构建了基于介孔二氧化硅纳米载体(mesoporous silica nanoparticles, MSN)的核酸和化疗药物靶向共递送系统,以小鼠原位结肠肿瘤为模型,成功实现了化疗和抗血管生成协同联合治疗。
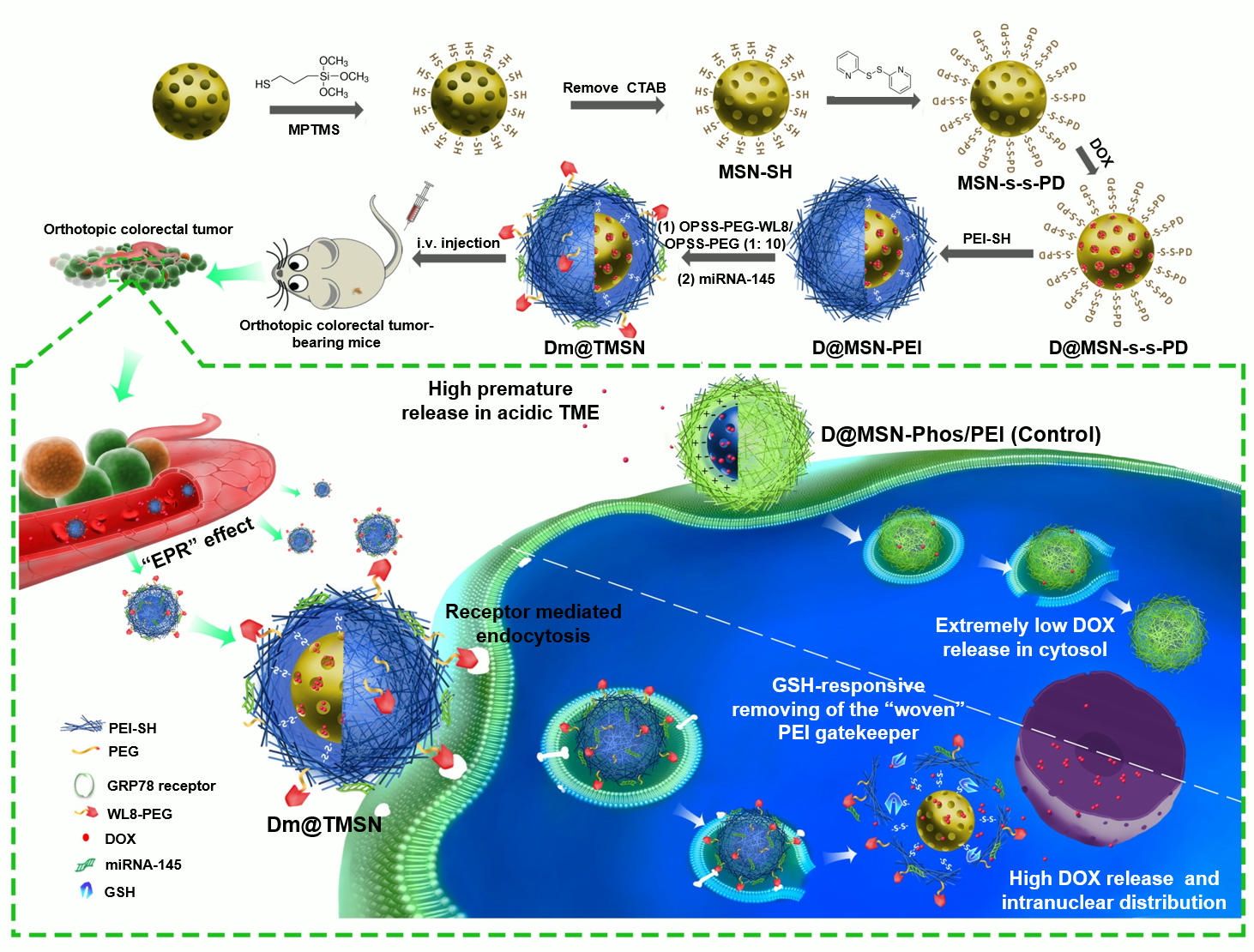
肿瘤的发生发展是一个涉及多因子、多步骤的复杂的生物学过程,具有高度复杂的调控网络和多种逃避凋亡的机制。因此,除可手术切除的适应症外,采用单一方法治疗肿瘤的疗效常常不佳,而采用多种治疗手段联用或多种药物联合治疗(combination therapy)是当前临床抗肿瘤治疗的常规模式。FDA 近年来更是积极倡导开发新型的药物联合治疗肿瘤的临床方案。
药物原型形式联合治疗虽可显著提高抗肿瘤疗效,但由于药物差异的体内药动学行为和药效学水平上的脱靶作用,联合应用通常疗效不佳且毒性显著。由于具有很好的肿瘤靶向特性,纳米药物递送系统用于抗肿瘤药物联合治疗优势明显。近年来,核酸药物和化疗药物纳米载体共递送用于肿瘤的靶向治疗逐渐发展成为纳米药物研究的热点领域。介孔二氧化硅纳米粒(MSN)由于具有独特的结构特征、易于多样性功能化修饰和很好的生物相容性,已广泛用于生物医学研究,其作为核酸(如Micro RNA)和化疗药物(如阿霉素DOX)共递送系统的尝试近年来也开始有一些报道。方超课题组通过调研这些文献发现,DOX从MSN中释放需高度依赖溶酶体的酸性环境;然而,成功的核酸递送必须尽快突破溶酶体的约束实现胞浆递送,这一对矛盾导致DOX在纳米载体进入靶细胞后很长时间都无法实现肿瘤细胞内高效率释放而进入细胞核,严重影响了两类活性分子的协同治疗效果。

为“和解”这两种需求,课题组发明了基于MSN的新型共递送策略,首次将阳离子聚合物(PEI)通过二硫键“编织”在MSN的表面,作为有效的MSN守门分子,这一设计既保留和发挥了PEI 经典的质子海绵作用用以核酸药物(MicroRNA-145)递送,又克服了已有文献报道中DOX在肿瘤细胞外微环境中非靶向提前释放和肿瘤细胞内低效率释放等瓶颈问题。课题组进一步通过整合多肽介导的主动靶向策略,以原位结肠肿瘤小鼠为模型,成功实现了化疗和抗血管生成协同联合治疗。
上海交通大学基础医学院博士研究生刘海军为该论文的第一作者。上海交通大学基础医学院的方超教授和上海健康医学院药学院赵梅副教授为该论文的共同通讯作者。上海交通大学基础医学院陈红专教授、University at Buffalo(State University of New York)的Jonathan F. Lovell教授和上海交通大学医学院附属同仁医院普外科孙鹏主任给予了重要支持。该研究获得国家自然科学基金委和上海市科委项目的资助。
方超教授课题组主要从事肿瘤靶向治疗新型药物递送系统研究,针对递送系统在体内循环、肿瘤积聚、组织渗透、靶向摄取和药物释放等五个关键环节中的瓶颈问题,设计构建了一系列新型纳米药物,成功实现了对肿瘤的精准靶向治疗和多模式联合治疗,取得了系列创新成果。以通讯作者在Advanced Functional Materials, ACS Nano, Biomaterials (包括Leading Opinion Paper)等期刊发表论文30余篇,他引1500余次。主持国家自然科学基金5项和上海市曙光学者、浦江人才、青年科技启明星等项目。曾获中国药学会赛洛菲青年生物药物奖、上海市卫生系统银蛇奖和首届上药杏林育才奖等。培养的研究生5人获上海市研究生优秀成果(学位论文),8人被评为上海市或上海交通大学优秀毕业生。
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adfm.201801118?af=R