
 探索发现 · 交大智慧
探索发现 · 交大智慧
交大课题组发展药物设计方法实现STAT3原创变构抑制剂的发现
上海交通大学医学院张健课题组发展了一种基于蛋白结构的精准变构药物筛选设计方法,成功发现抗肿瘤靶标STAT3的全新变构位点及变构抑制剂。5月11日, 国际著名期刊Nucleic Acids Research杂志(IF=10.162)在线发表了张健课题组这一最新研究成果,题目为“AlloFinder: a strategy for allosteric modulator discovery and allosterome analyses”,文章中利用发展的全新变构药物设计技术AlloFinder,发现了STAT3在C端coiled-coil结构域的全新变构位点及新型变构抑制剂,为针对STAT3的抗肿瘤药物发现开辟了新的思路。
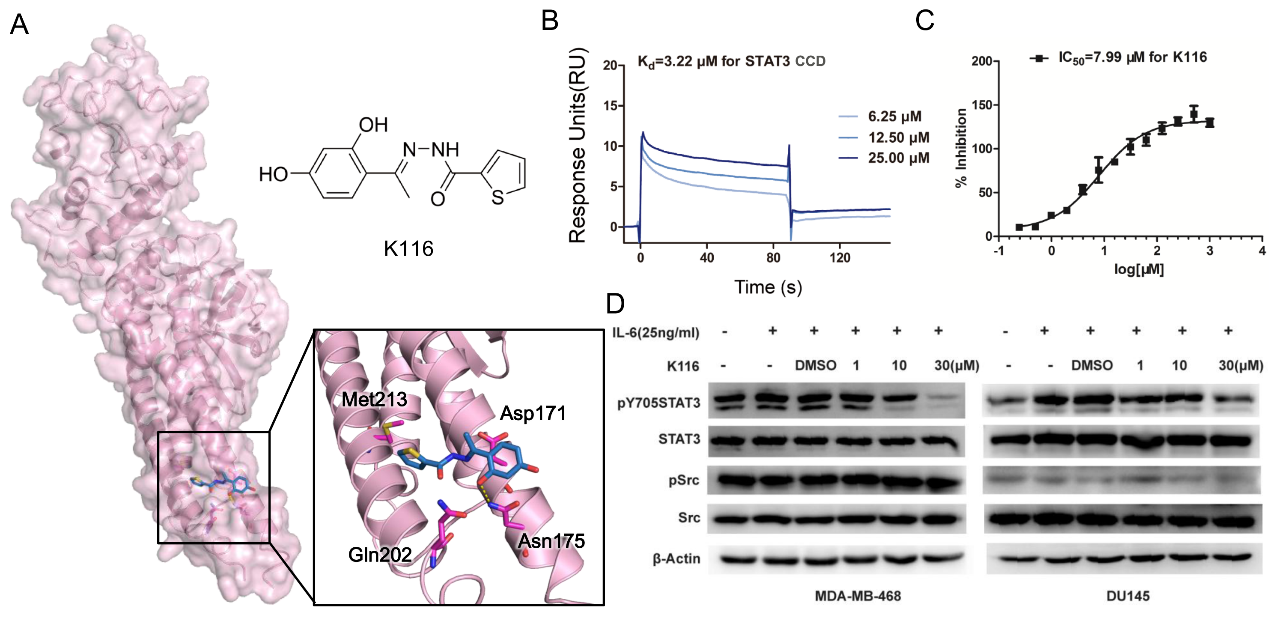
STAT3(Signal Transducer and Activator of Transcription 3)属于细胞信号传导与激活因子STAT蛋白家族的成员,是一类由细胞因子、生长因子等多肽配体激活的转录因子,主要介导细胞生长、分化、迁移和凋亡等生理功能,其异常激活与细胞恶性转化、肿瘤增殖、分化和凋亡障碍密切相关。由于在导致肿瘤发生和发展进程中的关键作用,STAT3已成为当前抗肿瘤药物开发中的一个热点,国际上各大医药公司和学术机构纷纷开始投入大量人力物力开展这方面的研究。然而,目前在研的STAT3抑制剂主要集中在结合于STAT3的功能位点,SH2结构域的酪氨酸磷酸化位点,来抑制STAT3的激活。SH2结构域在多种酪氨酸蛋白中高度保守,且其位点正电荷残基富集,对小分子所携带的负电荷要求高,因此针对SH2功能位点的抑制剂普遍存在毒副作用大、药动药代特征差的缺点。
针对这一挑战,张健课题组在长期对变构药物研究的基础上,发展了针对变构药物的设计策略AlloFinder,发现STAT3除了SH2结构域可以进行抑制剂药物开发外,在其C端的CCD(coiled-coil domain)区域也存在着可以抑制STAT3自身二聚化进而调控DNA转录的位点,并在此位点上精准筛选到变构活性小分子K116。 K116对STAT3的半数有效抑制浓度(IC50)达到7.99μM,多重点突变实验进一步证实该化合物在CCD位点上的结合模式。
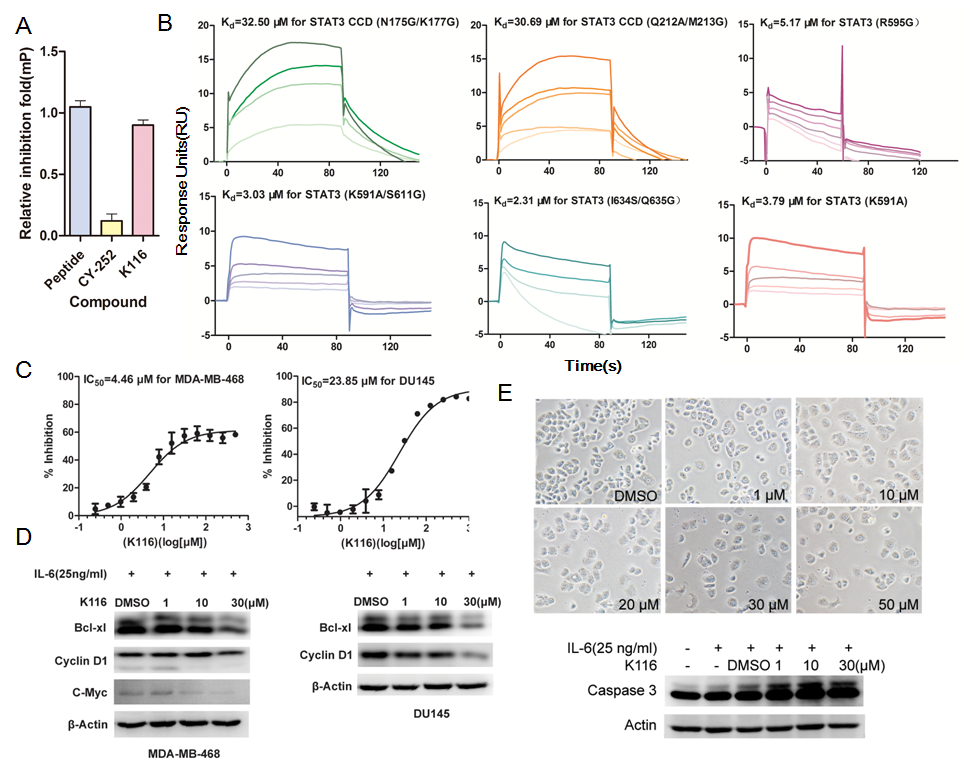
进一步研究发现,K116可以有效诱导肿瘤细胞凋亡,抑制并杀伤MDA-MB-468和DU145等多种STAT3过度激活诱导的肿瘤细胞。为STAT3上CCD区域的变构位点也可以进行药物发现提供了重要证据。
上海交通大学医学院张健教授为本文的通讯作者。上海交通大学医学院陈国强院士和中国科学院上海有机研究所王任小研究员也对本工作做出重要贡献。
张健课题组长期致力于药物设计领域,特别是在变构药物设计方法发展、精准靶标识别和First-in-class药物发现等方向做出了一系列突破性成果。近年来以通讯作者在Nat Chem Biol、Am J Hum Genet、Nucleic Acids Res、Cell Res等期刊发表论文60余篇,由于在变构药物设计领域的连续贡献,受邀以通讯作者在国际著名综述杂志Chem Rev和Chem Soc Rev撰写变构展望综述,均作为封面文章重点推荐(http://mdl.shsmu.edu.cn)。AlloFinder作为其课题组最新发展的变构药物设计发展技术,为国际药物发现领域在重大疾病靶标上进行变构药物的筛选和发现提供了重要方法。
论文链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gky374/4994952?searchresult=1