
 探索发现 · 交大智慧
探索发现 · 交大智慧
上海交大代彬团队发表石墨烯量子点调控蛋白异常相分离的研究进展
近日,上海交通大学电子信息与电气工程学院感知科学与工程学院代彬团队和Bio-X研究院李丹团队及上海大学环境与化学工程学院王亮团队联合研究,在使用石墨烯量子点调控渐冻人症致病蛋白异常相分离的领域取得了重大进展。相关研究成果以“Halogen doped Graphene Quantum Dots Modulate TDP-43 Phase Separation and Aggregation in the Nucleus”(石墨烯量子点抑制渐冻人症致病蛋白TDP-43和FUS液-液相分离及淀粉样纤维聚集的形成)为题发表在《Nature Communications》杂志上。

在正常生理状态下,蛋白质通过液-液相分离(LLPS)执行多种重要生物学功能,尤其是在无膜细胞器动态组装中起到关键作用。然而,一旦相分离过程发生异常,蛋白质可能从可逆的液-液相转变为不可逆的液-固相,从而形成不可逆的淀粉样聚集,这一不可逆的聚集过程与多种神经退行性疾病如肌萎缩侧索硬化症(ALS)等密切相关。因此,有效调控蛋白的异常相分离过程,进而抑制淀粉样纤维的形成,成为当前研究的重点。
石墨烯量子点(GQDs)凭借其能够穿透血脑屏障的能力、良好的生物相容性、高度的可定制性以及出色的光学特性,在化学生物学、生物医学和材料科学等多个领域展示出广泛的应用前景。基于此,本研究致力于设计和合成可以靶向细胞质与细胞核的GQDs,并深入研究了这些GQDs对于ALS相关致病蛋白FUS与TDP-43相分离行为以及淀粉样纤维形成过程的影响,从而为神经退行性疾病的研究与治疗开辟了新的视角和策略。
上海交通大学代彬团队、Bio-X研究院李丹团队和上海大学王亮团队联合发现,GQDs能够靶向细胞核调控渐冻人症TDP-43蛋白的相分离和不可逆聚集现象。尽管当前许多研究集中于调控TDP-43在细胞质中的聚集,但越来越多证据表明,在神经退行性疾病(如额颞叶痴呆症和阿尔茨海默病)受影响的大脑区域,细胞核内也会存在TDP-43聚集。该研究团队使用1,5-二氨基萘作为前体,合成了三种氯元素修饰的GQDs,这些GQDs能够进入细胞核(图1 a-c)。
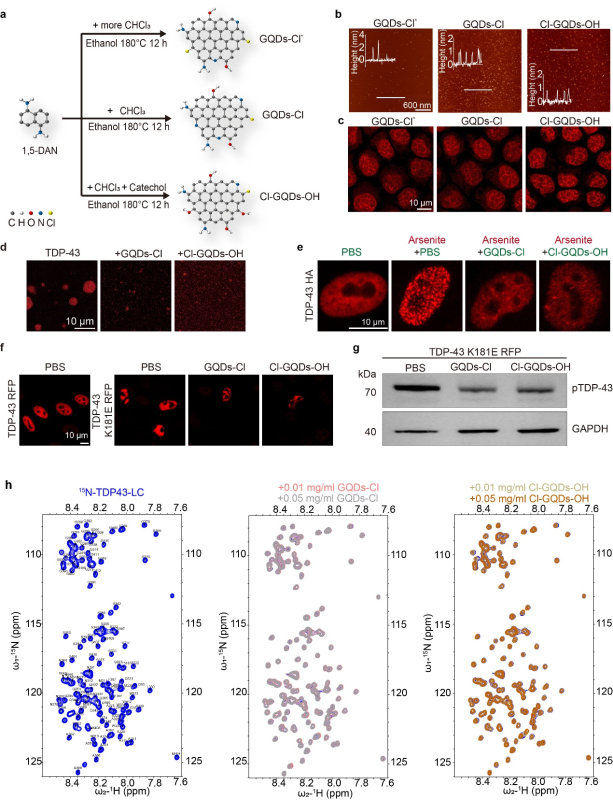
靶向细胞核GQDs的设计、合成以及它们在细胞核中调节TDP-43蛋白相分离和淀粉样纤维聚集过程中的作用
研究结果表明,氯元素修饰的GQDs能在多种细胞中抑制氧化应激或高渗刺激下TDP-43颗粒的形成(图1 d-e)。另外,GQDs抑制了细胞核TDP-43淀粉样纤维聚集的形成和疾病相关的TDP-43磷酸化水平,同时不影响蛋白的表达(图1 f-g)。深入的机制研究表明,GQDs通过疏水作用和静电作用调节TDP-43相分离,并且能够与TDP-43的各结构域直接结合,尤其与TDP-43 LC结构域的结合更为紧密,且利用液态核磁技术分析显示这种相互作用不依懒于特定的氨基酸(图1 h)。该研究展示了GQDs在调节细胞核蛋白的LLPS及淀粉样纤维聚集过程中的应用潜力。
靶向细胞核GQDs的设计、合成以及它们在细胞核中调节TDP-43蛋白相分离和淀粉样纤维聚集过程中的作用
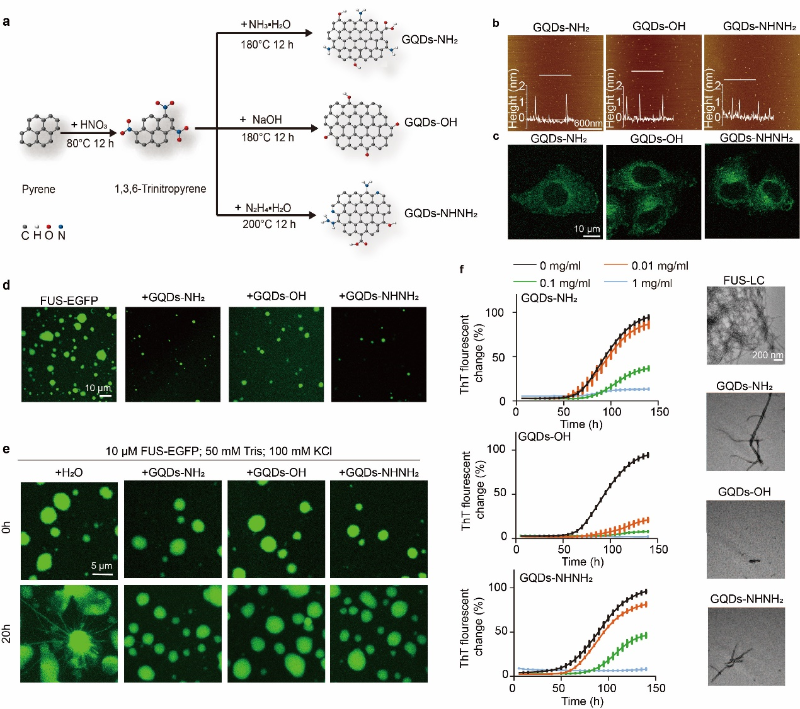
在2023年,代彬团队、李丹团队与王亮团队联合发现,GQDs能够靶向细胞质调控渐冻人症中FUS蛋白的相分离和不可逆聚集(ACS Nano 2023, 17, 11, 10129–10141)。团队设计合成了三种不同表面基团修饰的GQDs,这些GQDs不仅粒径均一,而且能够进入到细胞质中(图2 a-c)。实验结果显示,这三种GQDs可以与FUS液滴共定位,并显著抑制FUS蛋白的LLPS(图2 d)。此外,GQDs可以稳定FUS蛋白形成的液滴状态,有效抑制FUS液滴中淀粉样纤维的生成(图2 e)。GQDs还显示出能够抑制FUS-LC的淀粉样纤维的形成,并可以分解预先形成的FUS-LC纤维(图2 f)。进一步深入探究GQDs与FUS蛋白相互作用的分子机制时,研究发现这三种GQDs均能与FUS-LC单体和FUS-LC淀粉样纤维结合,但具有不同的结合强度。因此,通过精细设计GQDs的表面基团,可以调控其对蛋白质相分离和纤维化聚集的调节作用。这项发现不仅揭示了GQDs在调控蛋白质相分离和纤维化中的应用潜力,也为设计新型纳米材料以调控蛋白质相分离行为奠定了基础。
GQDs调节蛋白LLPS和纤维化的示意图
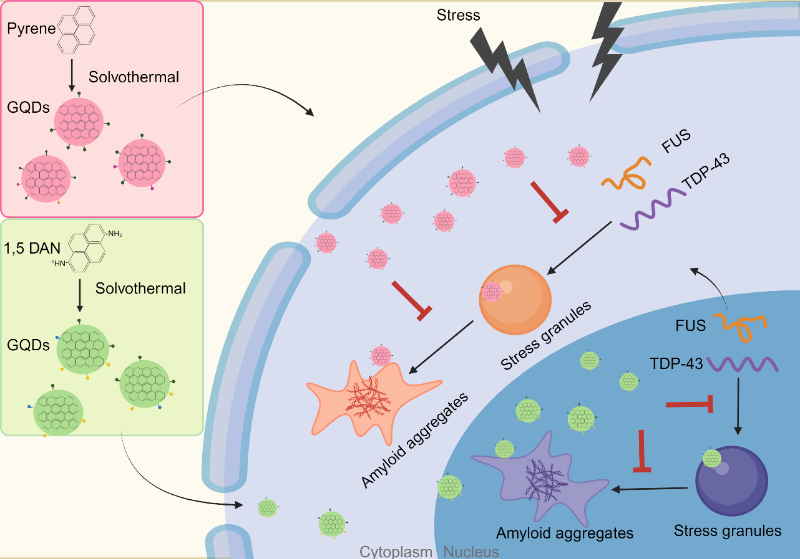
这两项研究共同展示了GQDs在调控ALS关键致病蛋白FUS和TDP-43在细胞核和细胞质的生物分子凝聚体的组装与解聚,及其在抑制或逆转淀粉样纤维化方面的显著能力(图3)。深入探讨GQDs与这些蛋白相互作用的机制不仅揭示了GQDs在治疗ALS领域的应用潜力,同时也深化了对ALS致病机制特别是蛋白质异常相分离调控机制的理解,为发展新的治疗策略和视角奠定了坚实的基础。
上海交大电院感知学院博士生张宏为第一作者,上海交大电院感知学院代彬、上海交通大学Bio-X研究院李丹与上海大学王亮担任通讯作者,中科院生物与化学交叉研究中心刘聪研究员及本文其他作者均做出了重要贡献。上海交通大学电子信息与电气工程学院为第一单位,该工作得到了国家自然科学基金、上海市浦江人才计划等支持。