
 探索发现 · 交大智慧
探索发现 · 交大智慧
《细胞》杂志发表附属九院雷鸣团队在核酶领域的又一项重大突破
国际权威学术期刊《细胞》(Cell)于北京时间10月26日在线发表了上海交通大学医学院附属第九人民医院精准医学研究院雷鸣课题组的最新研究成果“Cryo-EM structure of the human Ribonuclease P holoenzyme”,揭示了人源关键核酶RNase P催化tRNA前体加工成熟的分子机制。这是第一个高分辨率的人源RNase P 结构,也是继雷鸣团队在于9月在Science 杂志揭示了酵母RNase P的工作机理后,在高等生物中阐释核酶RNase P的组装和工作原理的又一力作。
转运RNA(tRNA)作为生命体中遗传信息的传递者,首先是以前体RNA的形式被转录出来,转录生成的tRNA前体具有未成熟的5’和3’末端,需要经历一系列的加工反应才能完成最终的成熟。其中5’前导序列的切割是由一类必需的核酶RNase P完成。人源RNase P 是由一条长链非编码RNA和十个蛋白质亚基组成的核糖核酸蛋白质复合物,是人体内最重要的核酶之一。解析RNase P的高分辨率结构对于理解这类核酶加工tRNA的机理以及这一古老核酶的进化过程都至关重要。自上世纪80年代发现RNase P 并提出核酶这一概念以来,对于真核生物RNase P 的组装和工作机理一直所知甚少。附属九院附属第九人民医院雷鸣团队在世界上率先解析了真核生物RNase P结合底物pre-tRNA的近原子分辨率结构,极大的推动了核酶及RNA结构生物学这一领域的发展。
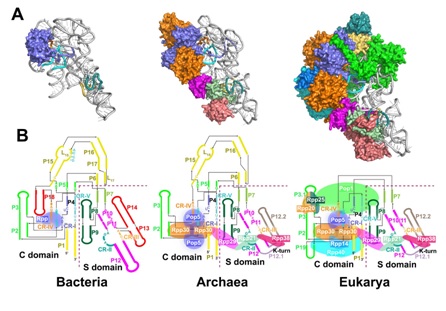
在最新发表的Cell 论文中,雷鸣团队成功的从人的细胞中提取出RNase P复合物并利用冷冻电镜单颗粒重构技术解析了人源RNase P全酶及其与底物复合物的近原子分辨率结构。该结构揭示了人源RNase P 同样通过“双锚定”(double anchor)的机制来识别tRNA底物,tRNA的结合诱导了酶催化中心一个巨大的构象变化,使该酶从失活转化到活性状态。更为重要的是,该文章首次提出了RNase P 这一古老核酶的进化模型,揭示了细菌RNase P RNA亚基中的辅助RNA元件逐步退化,进化到高等生物中由更加复杂的蛋白质组分所替代。
附属九院精准医学研究院武健研究员,雷鸣课题组牛双双硕士及谭明博士为文章的共同第一作者;精准医学研究院雷鸣研究员与兰鹏飞助理研究员为该论文的通讯作者。上海交通大学医学院附属第九人民医院是第一单位;该研究受到国家自然科学基金项目以及中科院战略性先导项目(B类)资助。
论文链接:https://doi.org/10.1016/j.cell.2018.10.003