
 探索发现 · 交大智慧
探索发现 · 交大智慧
附属第一人民医院研究团队获得胰腺癌免疫逃逸机制新发现
上海交通大学附属第一人民医院普外科裘正军教授领衔团队经过多年研究,日前在肿瘤转移机制上实现突破:肿瘤细胞通过携带信号分子的外泌体驯化巨噬细胞,逃脱免疫监控,实现远处转移。相关研究成果发表在最新一期国际权威肿瘤学杂志《癌症研究》(Cancer Research,影响因子9.122)上。
以胰腺癌为主的消化道肿瘤约占恶性肿瘤总量的“半壁江山”。胰腺癌是一种发病隐匿,进展迅速,预后极差的消化道恶性肿瘤,素有癌症之王的称呼。主要原因在于其早期难诊断、易转移。因此阐明其复发转移的具体机制,寻找新的分子诊疗靶点,对临床上制定更有效的防治策略具有重要意义。
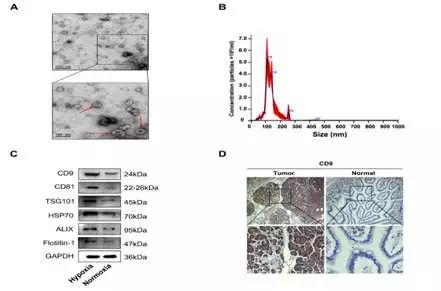

课题组首先采用电镜和NTA等技术,测定了低氧可以使得肿瘤细胞分泌的外泌体增多。通过免疫组化染色可看到肿瘤组织中外泌体标记物相对于癌旁正常组织明显增高。外泌体是由细胞在胞吞过程中产生的直径在30-150nm的膜性囊泡,能携带DNA、miRNA等各种生物活性分子,进行细胞间信息交流,广泛存在于血液、尿液等各种体液中。这就为肿瘤细胞“拉帮结派”以实现“阵地转移”提供了“通讯手段”。
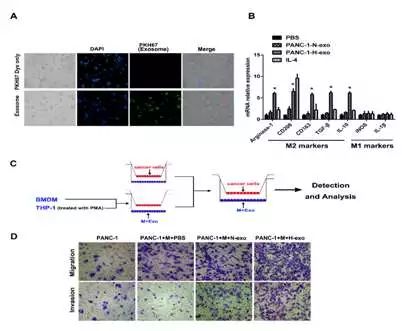
接下来课题组将低氧下肿瘤细胞分泌的外泌体与巨噬细胞共孵育之后,有趣的事情发生了,摄取了外泌体之后的巨噬细胞“叛变”了,巨噬细胞被“驯化”成了M2型巨噬细胞。研究已知,M2型巨噬细胞能参与抗炎反应、血管生成、以及促进肿瘤生长转移等。被外泌体诱导极化之后的M2巨噬细胞开始“助纣为虐”,极大地促进了肿瘤细胞的转移。这说明肿瘤细胞在发生转移的过程中,能有效利用肿瘤微环境中别的基质细胞,“拉帮结派”,来达到自己的目的。
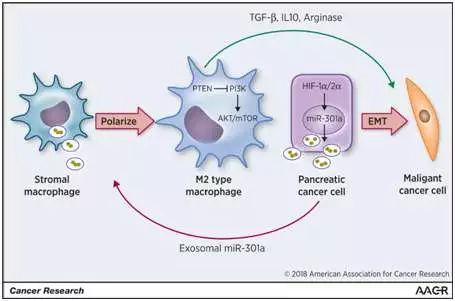
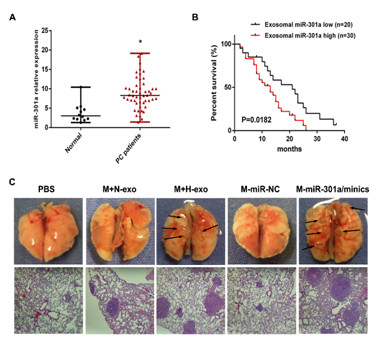
课题组利用miRNA芯片技术检测到miRNA-301a在低氧下表达明显升高了,将富集了miRNA-301a的外泌体与巨噬细胞共孵育之后,巨噬细胞中miRNA-301a的表达也明显升高。进一步的研究分析,miRNA-301a通过下调抑癌基因PTEN,激活PI3Kγ这一巨噬细胞M2极化的关键信号分子,从而实现“驯化”巨噬细胞这一目的。为验证miRNA-301a在肿瘤诊断以及预后中的价值,课题组检测了肿瘤病人血液外泌体中miRNA-301a的表达,发现其与病人的TNM分期成正相关,与生存率成负相关。继而通过独立回归分析发现,miRNA-301a可以作为胰腺癌的独立预后因素。此外通过尾静脉注射构建裸鼠肺转移模型,发现体内被肿瘤细胞外泌体诱导极化后的巨噬细胞同样能促进肿瘤细胞的转移。
通过这项研究,裘正军教授研究团队首次证实了Exosomal-miR-301a在肿瘤免疫逃逸以及转移中的调控作用。Exosomal-miR-301a作为促癌分子,有可能成为以胰腺癌为主的消化道肿瘤新的诊疗靶点,具有重要理论价值和临床意义。
论文链接: http://cancerres.aacrjournals.org/cgi/content/abstract/0008-5472.CAN-17-3841
DOI: 10.1158/0008-5472.CAN-17-3841